题目内容
将24.4g NaOH固体溶于水配成100mL溶液,其密度为1.219g/mL.
(1)该溶液中NaOH的物质的量浓度为______.
(2)该溶液中NaOH的质量分数为______.
(3)从该溶液中取出10mL,其中NaOH的物质的量浓度为______,含NaOH的质量为______.
解:(1)24.4 g NaOH的物质的量为 =0.61 mol,故c(NaOH)=
=0.61 mol,故c(NaOH)= =6.1 mol/L,
=6.1 mol/L,
故答案为:6.1 mol/L;
(2)100 mL NaOH溶液的质量为100 mL×1.219 g/mL=121.9 g,故NaOH的质量分数为 ×100%=20%,
×100%=20%,
故答案为:20%;
(3)溶液是均匀的,取出的10mL溶液以及剩余的溶液与原溶液相比,氢氧化钠的物质的量浓度不变为6.1mol/L,但10mL溶液中氢氧化钠的质量为原溶液的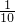 ,故10mL该氢氧化钠溶液中m(NaOH)=24.4g×
,故10mL该氢氧化钠溶液中m(NaOH)=24.4g× =2.44g,
=2.44g,
故答案为:6.1mol/L;2.44g.
分析:(1)根据n= 计算24.4 g NaOH的物质的量,再根据c=
计算24.4 g NaOH的物质的量,再根据c= 计算氢氧化钠溶液的物质的量浓度;
计算氢氧化钠溶液的物质的量浓度;
(2)根据m=ρV计算溶液的质量,再根据溶质质量分数=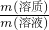 ×100%计算;
×100%计算;
(3)溶液是均匀的,取出的10mL溶液以及剩余的溶液与原溶液相比,氢氧化钠的质量分数、物质的量浓度或溶液的密度均相同,但10mL溶液中氢氧化钠的质量为原溶液的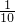 .
.
点评:本题考查物质的量浓度、质量分数的有关计算,比较基础,旨在考查学生对基础知识的理解掌握,注意对定义式的理解与灵活运用.
 =0.61 mol,故c(NaOH)=
=0.61 mol,故c(NaOH)= =6.1 mol/L,
=6.1 mol/L,故答案为:6.1 mol/L;
(2)100 mL NaOH溶液的质量为100 mL×1.219 g/mL=121.9 g,故NaOH的质量分数为
 ×100%=20%,
×100%=20%,故答案为:20%;
(3)溶液是均匀的,取出的10mL溶液以及剩余的溶液与原溶液相比,氢氧化钠的物质的量浓度不变为6.1mol/L,但10mL溶液中氢氧化钠的质量为原溶液的
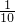 ,故10mL该氢氧化钠溶液中m(NaOH)=24.4g×
,故10mL该氢氧化钠溶液中m(NaOH)=24.4g× =2.44g,
=2.44g,故答案为:6.1mol/L;2.44g.
分析:(1)根据n=
 计算24.4 g NaOH的物质的量,再根据c=
计算24.4 g NaOH的物质的量,再根据c= 计算氢氧化钠溶液的物质的量浓度;
计算氢氧化钠溶液的物质的量浓度;(2)根据m=ρV计算溶液的质量,再根据溶质质量分数=
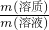 ×100%计算;
×100%计算;(3)溶液是均匀的,取出的10mL溶液以及剩余的溶液与原溶液相比,氢氧化钠的质量分数、物质的量浓度或溶液的密度均相同,但10mL溶液中氢氧化钠的质量为原溶液的
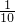 .
.点评:本题考查物质的量浓度、质量分数的有关计算,比较基础,旨在考查学生对基础知识的理解掌握,注意对定义式的理解与灵活运用.

练习册系列答案
相关题目
用沉淀法测定NaHCO3和K2CO3混合物的组成,实验过程是每次称取一定质量的样品溶于水制成溶液,向其中滴加相同浓度
的Ba(OH)2溶液,充分反应,实验记录见下表:
| 实验次数 | 称取样品质量/g | 所加Ba(OH)2溶液的体积/L | 测得生成沉淀的质量/g |
| 1 | 0.858 | 0.5 | 1.379 |
| 2 | 1.716 | 0.5 | ? |
| 3 | 2.574 | 0.5 | 4.137 |
| 4 | 3.432 | 0.5 | 5.516 |
| 5 | 4.290 | 0.5 | 5.516 |
| 6 | 5.148 | 0.5 | 5.516 |
(1)第2次实验中产生的沉淀质量是______.
(2)样品中NaHCO3和K2CO3的物质的量之比是______.
(3)室温下取第3组实验所得溶液体积的1/10,加水配成500mL 溶液,稀释以后溶液的pH值为______(写出计算过程)
 ↓
↓ ↓+H2O
↓+H2O