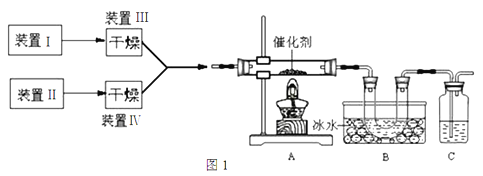
��Ŀ����
����Ŀ��ij±�����Ҫ�ɷ���MgCl2�������Fe3+��Fe2+��Mn2+�����Ӻ�����������[CO(NH2)2]�����ø�±��Ϊԭ��������������þ�Ĺ���������ͼ��

����ؽ�������[c0(Mn+)��0.1molL��1]ʱ���γ��������������pH��Χ�����
�������� | Fe2+ | Fe3+ | Mn2+ | Mg2+ |
��ʼ������pH | 7.6 | 2.7 | 8.3 | 9.6 |
������ȫ��pH | 8.3 | 3.7 | 9.8 | 11.1 |
�ش��������⣺
(1)NaClO����Ԫ�صĻ��ϼ�Ϊ_____��NaClOΪƯ��Һ����Ҫ�ɷ֣�д���Ʊ�Ư��Һ�����ӷ���ʽ_____��
(2)����Һb���������ӵ�Ũ�Ⱦ�Ϊ0.1molL��1����Ҫʹ�������ӳ�����ȫ�������Ӧ��Һ��pH������_____��������A����Mn(OH)2��_____��
(3)����ʵ��������ɲ���ޣ��������CӦ��_____(����������)�����ա�д������Ļ�ѧ����ʽ_____��
(4)����ڼ���NaClO���ܳ�ȥ±���е�����[CO(NH2)2]������һ���κ����������弰ˮ���仯ѧ����ʽΪ_____������ȥ±���к��е�0.02molCO(NH2)2��������NaClO������Ϊ_____��
���𰸡�+1 Cl2+2OH����Cl��+ClO��+2H2O 9.8 Fe(OH)3��Mg(OH)2 ���� Mg(OH)2![]() MgO+H2O CO(NH2)2+3NaClO��3NaCl+N2��+CO2��+2H2O 4.47g
MgO+H2O CO(NH2)2+3NaClO��3NaCl+N2��+CO2��+2H2O 4.47g
��������
±���ˮ�ܽ⣬����NaClO��Fe2+������Fe3+��ͬʱ������ȥ±���е�����[CO(NH2)2]������pH��9.8������Mn2+��Fe3+��������Mg2+Ҳ����������Գ�����A����Mn(OH)2��Fe(OH)3��Mg(OH)2��Ȼ������Һ�м��봿�Mg2+����Һ����MgCO3����������Ȼ���ˮ��пɵõ�Mg(OH)2�����պ�õ�MgO���ݴ˷�������
(1)NaClO����Ԫ��+1�ۣ���Ԫ�ة�2�ۣ�����Ԫ��+1�ۣ�NaClOΪƯ��Һ����Ҫ�ɷ֣�һ������������NaOH��Һ��Ӧ�Ʊ������ӷ���ʽΪ��Cl2+2OH����Cl��+ClO��+2H2O��
(2)����Һb���������ӵ�Ũ�Ⱦ�Ϊ0.1molL��1������۵�����ҺpH��Ŀ���dz�ȥMn2+��Fe3+��Ҫʹ�������ӳ�����ȫ�����ݱ���֪����pH������9.8��ͬʱþ������9.6��ʼ����������þ����Ҳ�������ʳ�����A����Mn(OH)2��Fe(OH)3��Mg(OH)2��
(3)�����Ϊ���գ������������н��У���ӦΪ��Mg(OH)2![]() MgO+H2O��
MgO+H2O��
(4)����ڼ���NaClO���ܳ�ȥ±���е�����[CO(NH2)2]������һ���κ����������弰ˮ��ΪNaCl�������Ͷ�����̼�����ݵ����غ��Ԫ���غ�ɵ÷�ӦΪ��CO(NH2)2+3NaClO��3NaCl+N2��+CO2��+2H2O�����ݷ���ʽ��֪������ȥ±���к��е�0.02molCO(NH2)2��������NaClO�����ʵ���Ϊ0.06mol������Ϊ0.06mol��74.5g/mol��4.47g��

����Ŀ��ʵ����������������������Ҵ��Ʊ�1��2���������װ����ͼ��ʾ��

�й������б����£�
�Ҵ� | 1��2�������� | ���� | |
״̬ | ��ɫҺ�� | ��ɫҺ�� | ��ɫҺ�� |
�ܶ�/gcm3 | 0.79 | 2.2 | 0.71 |
�е�/�� | 78.5 | 132 | 34.6 |
�۵�/�� | -l30 | 9 | -116 |
�ش��������⣺
��1��д����ʵ������з�����������Ҫ��Ӧ�Ļ�ѧ����ʽ____��
�ڴ��Ƹ�ʵ���У�Ҫ������Ѹ�ٵذѷ�Ӧ�¶�170�����ң�������ҪĿ����___(����ȷѡ��ǰ����ĸ����ͬ)
a.������Ӧ b.�ӿ췴Ӧ�ٶ� c.��ֹ�Ҵ��ӷ� d.���ٸ�������������
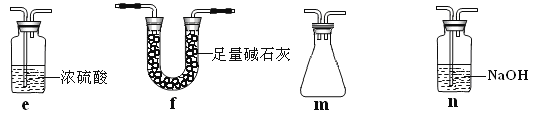
��2����װ��C��Ӧ����__����Ŀ�������շ�Ӧ�п������ɵ��������塣
a.ˮ b.Ũ���� c.����������Һ d.����̼��������Һ
��3����1��2��������ֲ�Ʒ���ڷ�Һ©���м�ˮ�����ã�����Ӧ��___�㣬��������������δ��Ӧ��Br2�������____ϴ�ӳ�ȥ��
a.ˮ b.����������Һ c.�⻯����Һ d.�Ҵ�
��4�������������������������ѡ�����____�ķ�����ȥ�����ȷ�ʽΪ____��
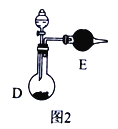
��5����Ӧ������Ӧ��___��ȴװ��D
A.��ˮ����� B.�����µ�ˮ C.60�� D.100��
����Ŀ�����ǻ������������㷺����ʳƷ����ױƷ��ҽҩ������ij��ѧ��ȤС��ͨ���������ף��Ʊ��ǻ��������������ش��������⣺
(һ)���ǻ������������ĺϳ�
ʵ��ԭ����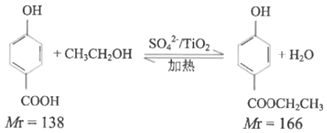
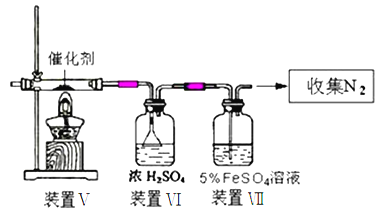
ʵ�鲽�裺ȡ0.4mol�Ҵ��ʹ������ڸ��������A�У�0.1mol���ǻ����������ں�ѹ��Һ©��C�У�ʵ��װ����ͼ��ʾ(���Ⱥͼг�װ��ʡ��)�����Ȼ�������ַ�Ӧ��
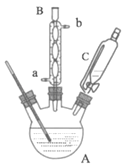
(1)����A��������_____������B������ˮ������Ϊ��_____(��a����b��)ͨ�롣
(2)ijͬѧ��������A������������֮���һ����ˮװ�ã��û�ѧƽ��ԭ���������������ŵ���_____��
(3)ȡ����2g�����ǻ�������0.1mol���Ҵ�0.4mol����Ӧ���������IJ����뷴Ӧʱ��Ĺ�ϵ���±���ʾ��
��Ӧʱ��/Сʱ | 1 | 3 | 4 | 5 | 6 |
���IJ���/% | 45.6 | 88 | 91.8 | 91.1 | 90.8 |
���ݱ������ݿ�֪����ѷ�Ӧ��ʱ��ӦΪ_____����Ӧʱ����������������½��Ŀ���ԭ����_____��
(��)���ǻ������������ľ���
ʵ�鷽�����ٷ�Ӧ��Ϻ�����˳���������Һ������ˮ�У��������壬���ˡ�
�ڹ����Ⱥ���5%��Na2CO3��Һ��ˮϴ�ӣ������õ��ֲ�Ʒ��
����װ�������ܵ�Բ����ƿ�У�����һ�����������Ʒ�����Ҵ���ˮ�ͻ���̿�����Ȼ���0.5Сʱ�����ȳ��ˣ���Һ��ȴ��������ɫ���壬��80���ɡ�
(4)�ڢ�����5%��Na2CO3��Һϴ�ӵ�Ŀ����_____���ܲ�����NaOH��Һ�����_____(��ܡ����ܡ�)��
(5)�ڢ۳��ȳ�����Ҫ��ȥ������Ϊ_____�������ȡ���Ŀ����_____��
(6)��С��ͬѧ��(3)������Ͷ�ϣ����õ����ǻ�����������14.9g�����ʵ��IJ���Ϊ_____%��