题目内容
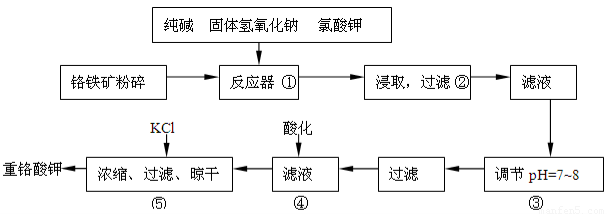
工业上利用铬铁矿(FeO?Cr2O3)冶炼铬的工艺流程如下:
(l)实验室焙烧铬铁矿可选用的装置是

(2)完成下列化学方程式(在横线上填写物质的化学式及计量数):
4CrO42-+6S+7H2O=4Cr(OH)3↓+3S2O32-+
(3)操作I包括过滤与洗涤,简述实验室中洗涤沉淀的操作:
(4)Cr(0H)3和Al(OH)3类似,也是两性氢氧化物,写出Cr(OH)3溶于浓氢氧化钠溶液的离子方程式
(5)由Cr2O3冶炼Cr的化学方程式为
(6)目前有一种采用以铬酸钠(Na2CrO4)为原料,用电化学法制备重铬酸钠(Na2Cr2O7)的实验装置如下图所示(已知:2CrO42-+2H+?Cr2O72-+H2O).

①出阴极的电极反应式为
②电解一段时间后,测得阳极区溶液中Na+物质的量由a mol变为b mol,则此时铬酸钠的转化率为
分析:(1)焙烧固体选用坩埚;
(2)根据电荷守恒和原子守恒判断;
(3)根据洗涤沉淀的操作方法分析;
(4)两性氢氧化物与强碱反应生成盐和水;
(5)利用铝热反应冶炼Cr;
(6)①电解池中阳离子在阴极得电子;
②根据电荷守恒计算.
(2)根据电荷守恒和原子守恒判断;
(3)根据洗涤沉淀的操作方法分析;
(4)两性氢氧化物与强碱反应生成盐和水;
(5)利用铝热反应冶炼Cr;
(6)①电解池中阳离子在阴极得电子;
②根据电荷守恒计算.
解答:解:(1)焙烧固体选用坩埚,所以实验室焙烧铬铁矿可选用的装置是d,故答案为:d;
(2)由电荷守恒和氧原子及氢原子原子守恒可知,缺的为2OH-,所以其方程式为4CrO42-+6S+7H2O=4Cr(OH)3↓+3S2O32-+2OH-,
故答案为:2OH-;
(3)洗涤沉淀要注意用玻璃棒引流,其操作方法为:将蒸馏水沿着玻璃棒慢慢倒入漏斗中浸没沉淀,待水流尽后,再重复操作2~3次,
故答案为:将蒸馏水沿着玻璃棒慢慢倒入漏斗中浸没沉淀,待水流尽后,再重复操作2~3次;
(4)两性氢氧化物与强碱反应生成盐和水,所以Cr(OH)3溶于浓氢氧化钠溶液的离子方程式为:Cr(OH)3+OH-=CrO2-+2H2O,
故答案为:Cr(OH)3+OH-=CrO2-+2H2O;
(5)利用铝热反应冶炼Cr,所以由Cr2O3冶炼Cr的化学方程式为:Cr2O3+2Al
2Cr+Al2O3,故答案为:Cr2O3+2Al
2Cr+Al2O3;
(6)①电解池中阳离子在阴极得电子,则阴极的电极反应式为:2H++2e-=H2↑,故答案为:2H++2e-=H2↑;
②电解一段时间后,测得阳极区溶液中Na+物质的量由a mol变为b mol,则溶液中移动的电荷为(a-b)mol,所以外电路中转移的电子为(a-b)mol,阳极的电极反应为:2H2O-4e-=O2+4H+,则阳极生成的氢离子为(a-b)mol,已知:2CrO42-+2H+?Cr2O72-+H2O,所以阳极消耗的CrO42-为(a-b)mol,
已知原溶液中CrO42-为
mol,因此铬酸钠的转化率为:
×100%=
×100%,故答案为:
×100%.
(2)由电荷守恒和氧原子及氢原子原子守恒可知,缺的为2OH-,所以其方程式为4CrO42-+6S+7H2O=4Cr(OH)3↓+3S2O32-+2OH-,
故答案为:2OH-;
(3)洗涤沉淀要注意用玻璃棒引流,其操作方法为:将蒸馏水沿着玻璃棒慢慢倒入漏斗中浸没沉淀,待水流尽后,再重复操作2~3次,
故答案为:将蒸馏水沿着玻璃棒慢慢倒入漏斗中浸没沉淀,待水流尽后,再重复操作2~3次;
(4)两性氢氧化物与强碱反应生成盐和水,所以Cr(OH)3溶于浓氢氧化钠溶液的离子方程式为:Cr(OH)3+OH-=CrO2-+2H2O,
故答案为:Cr(OH)3+OH-=CrO2-+2H2O;
(5)利用铝热反应冶炼Cr,所以由Cr2O3冶炼Cr的化学方程式为:Cr2O3+2Al
| ||
| ||
(6)①电解池中阳离子在阴极得电子,则阴极的电极反应式为:2H++2e-=H2↑,故答案为:2H++2e-=H2↑;
②电解一段时间后,测得阳极区溶液中Na+物质的量由a mol变为b mol,则溶液中移动的电荷为(a-b)mol,所以外电路中转移的电子为(a-b)mol,阳极的电极反应为:2H2O-4e-=O2+4H+,则阳极生成的氢离子为(a-b)mol,已知:2CrO42-+2H+?Cr2O72-+H2O,所以阳极消耗的CrO42-为(a-b)mol,
已知原溶液中CrO42-为
| a |
| 2 |
| (a-b) | ||
|
| 2(a-b) |
| a |
| 2(a-b) |
| a |
点评:本题考查较为综合,涉及实验操作、离子方程式的配平、离子方程式的书写、化学方程式的书写、电解原理的应用、根据方程式的计算等,题目难度中等,解答本题,要充分把握题给信息,牢固掌握物质的性质.

练习册系列答案
相关题目






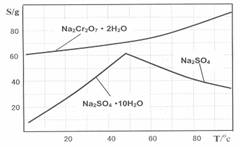 右图是Na2Cr2O7?2H2O和Na2SO4的溶解度曲线:
右图是Na2Cr2O7?2H2O和Na2SO4的溶解度曲线: