题目内容
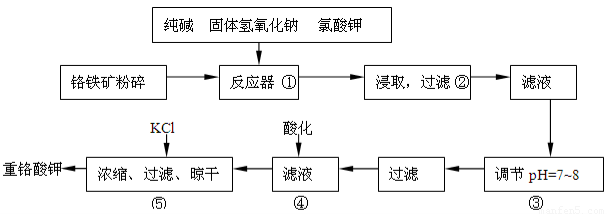
工业上利用铬铁矿(FeO Cr2O3)冶炼铬的工艺流程如下:
Cr2O3)冶炼铬的工艺流程如下:

(1)实验室焙烧铬铁矿可选用的装置是__________(填序号)。

(2)完成下列化学方程式(在横线上填写物质的化学式及计量数):4CrO42-+6S+7H2O=4Cr(OH)3↓+3S2O32-+_____________。
(3)操作I包括过滤与洗涤,简述实验室中洗涤沉淀的操作:__________________。
(4)Cr(OH)3和Al(OH)3类似,也是两性氢氧化物,写出Cr(OH)3溶于浓氢氧化钠溶液的离子方程式________________________________。
(5)由Cr2O3冶炼Cr的化学方程式为____________________________。
(6)目前有一种采用以铬酸钠(Na2CrO4)为原料,用电化学法制备重铬酸钠(Na2Cr2O7)的实验装置如下图所示(已知:2CrO42-+2H+ Cr2O72-+H2O)。
Cr2O72-+H2O)。

①写出阴极的电极反应式为________________________________________。
②电解一段时间后,测得阳极区溶液中Na+物质的量由a mol变为b mol,则此时铬酸钠的转化率为___。
(1)d (2分,大写字母不得分)? (2)2OH- (2分,计量数写错、化学式写错均不得分)
(3)将蒸馏水沿玻璃棒慢慢倒入漏斗中浸没沉淀(1分),待水流尽后,再重复操作2~3次(1分)? (共2分,合理答案即可)
(4)Cr(OH)3 + OH- = CrO2- + 2H2O (2分,化学式写错、不配平均不得分,写化学方程式不得分)
(5)Cr2O3 + 2Al 2Cr + Al2O3? (2分,不写反应条件不扣分,化学式写错、不配平不得分)
2Cr + Al2O3? (2分,不写反应条件不扣分,化学式写错、不配平不得分)
(6)①2H+ + 2e- = H2↑(或2H2O+2e-=2OH-+H2↑)(2分,化学式写错、不配平均不得分)(2分)
② ×100% (2分,合理答案即可)
×100% (2分,合理答案即可)
【解析】
试题分析:(1)固体灼烧需要在巩固中完成,根据装置图可知,a、b、c分别是蒸发、分液与过滤,d装置是坩埚,因此实验室焙烧铬铁矿可选用的装置是d。
(2)根据电荷守恒可知,该生成物是带负电荷的。根据原子守恒可知,该微粒石油氢原子和氧原子组成的,所以应该是OH-,计量数是2。
(3)过滤后得到的沉淀必须在过滤器中完成,所以实验室中洗涤沉淀的操作将蒸馏水沿玻璃棒慢慢倒入漏斗中浸没沉淀,待水流尽后,再重复操作2~3次;
(4)Cr(OH)3和Al(OH)3类似,也是两性氢氧化物。氢氧化铝与氢氧化钠溶液反应生成偏铝酸钠和水,因此Cr(OH)3溶于浓氢氧化钠溶液反应生成的是NaCrO2和水,反应的离子方程式为Cr(OH)3 + OH- = CrO2- + 2H2O。
(5)Cr的冶炼一般是通过铝热反应,所以由Cr2O3冶炼Cr的化学方程式为Cr2O3 + 2Al 2Cr + Al2O3。
2Cr + Al2O3。
(6)①电解池中阴极得到电子,发生还原反应。所以惰性电极电解铬酸钠溶液时阴极是溶液中的氢离子放电,反应的电极反应式为2H+ + 2e- = H2↑。
②电解一段时间后,测得阳极区溶液中Na+物质的量由a mol变为b mol。所以根据电荷守恒可知,阴极区生成氢氧化钠的物质的量是(a-b)mol,属于消耗氢离子的物质的量是(a-b)mol,所以根据方程式2CrO42-+2H+ Cr2O72-+H2O可知,消耗铬酸钠的物质的量是(a-b)mol。反应前铬酸钠的物质的量是0.5amol,所以铬酸钠的转化率是
Cr2O72-+H2O可知,消耗铬酸钠的物质的量是(a-b)mol。反应前铬酸钠的物质的量是0.5amol,所以铬酸钠的转化率是 ×100%=
×100%= ×100%。
×100%。
考点:考查化学实验基本操作、方程式配平、方程式书写、金属冶炼以及电解原理的应用与计算