题目内容
如图3-1所示,在密闭容器里盛有饱和H2S溶液和H2S气体。(1)饱和H2S溶液中存在的分子有____________,离子有______________________________。
(2)若将容器顶盖由a压到b位置,则H2S溶液中,各离子浓度的变化情况是________离子浓度增大,而________离子浓度减小。
(3)若从c处不断通入过量的SO2气体,溶液中H+浓度将( )
A.不断增大 B.先减小,后增大到某值 C.不变 D.先增大,后减小到某值
(4)若由c处不断通入N2,则溶液中H+浓度将________。(填“变大”“变小”或“不变”)
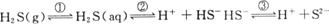
图3-1
解析:本题若不清楚氢硫酸的电离平衡,或忽略溶液中的H2O将会导致(1)中出错。若不用勒夏特列原理分析溶解平衡、电离平衡,将导致(2)题的分析中思维混乱。
解答本题的关键是要认识到密闭容器中存在如下平衡体系:
![]()
其中平衡①属气体的溶解平衡,②和③属电离平衡。
(1)由上述平衡体系可知,溶液中存在的分子有H2S、H2O;离子有H+、HS-、S2-、OH-。
(2)当顶盖由a压向b时,气体压强增大①向右移动,c〔H2S(aq)〕增大,致使平衡②③均右移。所以浓度增大的离子有H+、HS-、S2-;浓度减小的离子有OH-。
(3)通入SO2气体,SO2与H2S反应生成S和H2O,使H2S(g)浓度减小,平衡①左移,c〔H2S(aq)〕减小,故c(H+)、c(HS-)、c(S2-)均减小,当SO2过量时,SO2和H2O反应生成比氢硫酸酸性更强的H2SO3,故c(H+)再变大,若充入足量的SO2,最后溶液中c(H+)比原来更大。故选B。
(4)若由c处不断通入N2,则顶盖将向上移动,使H2S(g)的浓度减小,平衡①左移,导致c(H+)、c(HS-)、c(S2-)均减小。
答案:(1)H2S、H2O H+、HS-、S2-、OH-
(2)H+、HS-、S2- OH- (3)B (4)变小

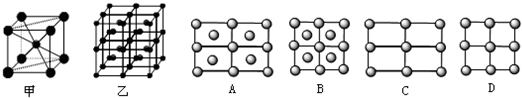
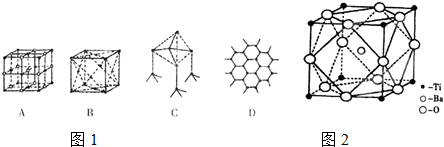
A.石英晶体中的硅原子以sp2杂化方式与周围的氧原子形成共价键
B.氯化钠晶体中每个Na+或Cl-周围紧邻的有6个Cl-或Na+
C.在CsCl晶体中每个Cs+周围紧邻的有8个Cl-,而和每个Cl-等距离紧邻的也有8个Cs+
D.在面心立方密堆积的金属晶体中,每个金属原子周围紧邻的有4个金属原子
(2)已知MgO的晶体结构属于NaCl型.某同学画出的MgO晶胞结构示意图如图1所示,请改正图
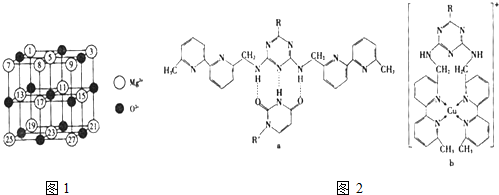
中错误:
(3)第三周期部分元素氟化物的熔点见下表:
| 氟化物 | NaF | MgF2 | SiF4 |
| 熔点/K | 1266 | 1534 | 183 |
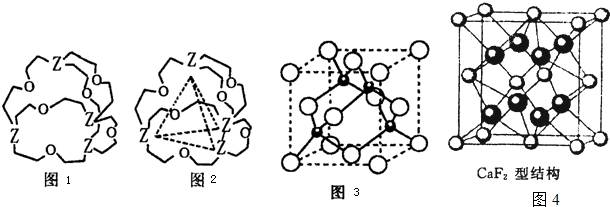
(4)人工模拟是当前研究的热点.有研究表明,化合物X可用于研究模拟酶,当其结合
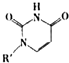 或Cu(I)(I表示化合价为+1)时,分别形成a和b:
或Cu(I)(I表示化合价为+1)时,分别形成a和b:分析a和b中微粒间的相互作用(包括化学键和分子间相互作用)的差异,试指出
其不同点:a中含