题目内容
17.有机物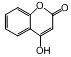 是一种医药中间体,常用来制备抗凝血药,有关该有机物的说法正确的是( )
是一种医药中间体,常用来制备抗凝血药,有关该有机物的说法正确的是( )| A. | 该有机物分子中含有4种官能团 | |
| B. | lmol该有机物最多能与5mol氢气发生加成反应 | |
| C. | 该有机物能与氯化铁溶液发生显色反应 | |
| D. | 该有机物能与氧氧化钠溶液反应,1mol有机物最多消耗2mol氢氧化钠 |
分析 由结构可知,分子中含-OH、碳碳双键、-COOC-,结合醇、烯烃、酯的性质来解答.
解答 解:A.含-OH、碳碳双键、-COOC-,有3种官能团,故A错误;
B.苯环与碳碳双键与氢气发生加成反应,则lmol该有机物最多能与4mol氢气发生加成反应,故B错误;
C.不含酚-OH,不能与氯化铁溶液发生显色反应,故C错误;
D.-COOC-及水解生成的酚-OH与NaOH反应,则该有机物能与氧氧化钠溶液反应,1mol有机物最多消耗2mol氢氧化钠,故D正确;
故选D.
点评 本题考查有机物的结构与性质,为高频考点,把握官能团与性质、有机反应为解答的关键,侧重分析与应用能力的考查,注意醇、烯烃、酯的性质应用,题目难度不大.

练习册系列答案
相关题目
5.根据下列实验操作和现象所得到的结论正确的是( )
| 选项 | 实验操作 | 实验现象 | 结论 |
| A | 测定等浓度的Na2CO3和Na2SO3溶液的pH | 前者pH比后者的大 | 非金属性:S>C |
| B | 向淀粉NaI溶液中加入氯水 | 溶液变蓝 | 氧化性:C12>I2 |
| C | 向等浓度的KCl、KI混合液中滴加AgNO3溶液 | 先出现黄色沉淀 | Ksp(AgCl)<Ksp(AgI) |
| D | 在酒精灯上加热铝箔 | 铝箔熔化但不滴落 | 熔点:氧化铝>铝 |
| A. | A | B. | B | C. | C | D. | D |
12.下列有关物质的浓度关系正确的是( )
| A. | 0.1mol•L-1HCl溶液与0.2 mol•L-1氨水等体积混合(pH>7):c(NH4+)>c(Cl-)>c(NH3•H2O)>c(OH-) | |
| B. | Na2CO3溶液中:c(Na+)<2c(CO32-)+c(HCO3-) | |
| C. | c(NH4+)相等的(NH4)2SO4、NH4HSO4、NH4Cl溶液中:c(NH4HSO4)>c(NH4Cl)>c[(NH4)2SO4] | |
| D. | 0.1mol•L-1(NH4)2Fe(SO4)2溶液中:c(NH4+)+c(NH3•H2O)+c(Fe2+)=0.3 mol•L-1 |
2.只表示一种微粒的化学用语是( )
| A. |  | B. | X:X | C. | ns1 | D. | X-X |
6.下列说法中不正确的是( )
| A. | 浓度均为0.1mol•L-1的小苏打溶液与烧碱溶液等体积混合:c(Na+)+c(H+)=2c(CO32-)+c(OH-)+c(HCO3-) | |
| B. | pH相同的盐酸和硫酸,分别用蒸馏水稀释至原体积的m倍和n倍,稀释后两溶液pH相等,则m>n | |
| C. | 常温下,0.1mol•L-1某一元酸HA在水中有0.1%发生电离,则该温度下HA的电离常数约为10-7 | |
| D. | 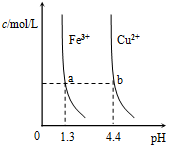 某温度下,Fe(OH)3,Cu(OH)2(s)分别在溶液中达到沉淀溶解平衡后,改变溶液的pH,金属阳离子浓度的变化如图.由图可知:Ksp[Fe(OH)3]<K[Cu(OH)2] |
16.7.5g镁铝合金完全溶解于100mL密度为1.40g/mL、质量分数为63%的浓硝酸中得到NO2和NO的混合气体11.2L(标准状况),向反应后的溶液中加入3.0mol/LNaOH溶液,当金属离子恰好完全沉淀时,得到19.4g沉淀,下列说法不正确的是( )
| A. | 该合金中铝与镁的物质的量之比是2:1 | |
| B. | 该浓硝酸中HNO3的物质的量浓度是14.0mol/L | |
| C. | NO2和NO的混合气体中,NO的体积分数是20% | |
| D. | 得到19.4g沉淀时,加入NaOH溶液的体积是300mL |
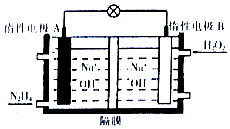 肼(N2H4)是一种高能燃料,在工业生产中用途广泛.
肼(N2H4)是一种高能燃料,在工业生产中用途广泛.