题目内容
已知25℃,醋酸、次氯酸、碳酸、亚硫酸的电离平衡常数如下表,下列叙述正确盼是( )
| 酸 | 电离平衡常数 |
| 醋酸 | Ki=1.75×10-5 |
| 次氯酸 | Ki=2.98×10-8 |
| 碳酸 | Ki1=4.30×10-7 Ki2=5.61×10-11 |
| 亚硫酸 | Ki1=1.54×10-2 Ki2=1.02×10-7 |
| A.将0.1 mol/L的醋酸加水不断稀释,c(CH3COO-)始终减小 |
| B.少量CO2通入NaClO溶液中反应的离子方程式为:CO2+H2O+2ClO-=CO32-+2HClO |
| C.少量的SO2通入Ca(ClO)2溶液中反应的离予方程式为:SO2+H2O+Ca2++2ClO-=CaSO3↓+2HClO |
| D.25℃,等浓度的CH3COONa、NaClO、Na2CO3和Na2SO3溶液中,碱性最强的是NaClO |
A.加水稀释醋酸溶液,能促进醋酸电离,但醋酸根离子增大程度小于溶液体积增大程度,所以醋酸根离子浓度减小,故A正确;
B.少量二氧化碳通入NaClO溶液中反应的离子方程式为:CO2+H2O+ClO-=HCO3+HClO,故B错误;
C.二氧化硫具有还原性,次氯酸根离子具有氧化性,二者能发生氧化还原反应生成硫酸根离子和氯离子,所以少量的SO2通入Ca(ClO)2溶液中反应的离子方程式为:SO2+H2O+Ca2++ClO-=CaSO4↓+Cl-+2H+,故C错误;
D.相同物质的量浓度的含有弱酸根离子的钠盐溶液,对应酸的酸性越弱则酸根离子水解程度越大,溶液中氢氧根离子浓度越大,PH越大,水解程度大小顺序是CH3COO-<SO3 2-<ClO-<CO32-,所以碱性最强的是碳酸钠溶液,故D错误;
故选A.
B.少量二氧化碳通入NaClO溶液中反应的离子方程式为:CO2+H2O+ClO-=HCO3+HClO,故B错误;
C.二氧化硫具有还原性,次氯酸根离子具有氧化性,二者能发生氧化还原反应生成硫酸根离子和氯离子,所以少量的SO2通入Ca(ClO)2溶液中反应的离子方程式为:SO2+H2O+Ca2++ClO-=CaSO4↓+Cl-+2H+,故C错误;
D.相同物质的量浓度的含有弱酸根离子的钠盐溶液,对应酸的酸性越弱则酸根离子水解程度越大,溶液中氢氧根离子浓度越大,PH越大,水解程度大小顺序是CH3COO-<SO3 2-<ClO-<CO32-,所以碱性最强的是碳酸钠溶液,故D错误;
故选A.

练习册系列答案
 快乐小博士巩固与提高系列答案
快乐小博士巩固与提高系列答案
相关题目
Ⅰ.下图为常见仪器的部分结构(有的仪器被放大)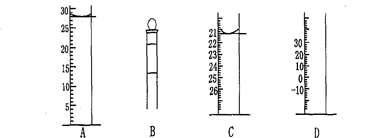
图A中液面所示溶液的体积为 mL,用上述四种仪器中的某种测量一液体的体积,平视时读数为n mL,仰视时读数为m mL,若m>n,则所使用的仪器是 (填字母标号)。
Ⅱ.某学生用标准0.25 mol·L—1 NaOH溶液滴定硫酸的实验操作如下:
| A.用酸式滴定管取稀H2SO4 25.00 mL,注入锥形瓶中,加入指示剂。 | |
| B.用待测定的溶液润洗酸式滴定管。 | C.用蒸馏水洗干净滴定管。 |
| D.取下碱式滴定管用标准的NaOH溶液润洗后,将标准液注入碱式滴定管刻度“0”以上2~3 cm处,再把碱式滴定管固定好,调节液面至刻度“0”或“0”刻度以下。 |
G.把锥形瓶放在滴定管下面,瓶下垫一张白纸,边滴边摇动锥形瓶直至滴定终点,记下滴定管液面所在刻度。
①滴定操作的正确顺序是(用序号填): 。
②该滴定操作中应选用的指示剂是: 。
③在G操作中如何确定终? 。
④碱式滴定管用蒸馏水润洗后,未用标准液润洗导致滴定结果(填“偏小”、“偏大”或“恰好合适”) ,原因是 。
⑤假设操作均正确,标准液消耗了22.18mL,计算待测硫酸溶液的物质的量浓度(计算结果精确到小数点后二位) mol·L—1
Ⅲ.已知常温时醋酸的电离常数为1.8×10-5,一水合氨的电离常数为1.8×10-5。在少量Mg(OH)2悬浊液中,滴加适量饱和NH4Cl溶液,固体溶解。对于固体的溶解。
甲同学认为在氢氧化镁悬浊液中存在下列平衡:
Mg(OH)2
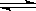 Mg2+ +2OH-
Mg2+ +2OH-加入NH4Cl溶液,由于NH4+水解产生H+中和了Mg(OH)2电离产生的OH-而使平衡右移导致Mg(OH)2 溶解。
而乙同学却认为NH4Cl电离产生的NH4+结合了OH-生成了弱电解质NH3·H2O,使c(OH-)减小,平衡右移而导致Mg(OH)2 溶解。设计方案评价甲乙两位同学的观点:
_____________________________________ ______________________________
_________________________________________________________________________
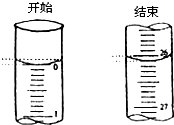 某学生欲用已知物质的量浓度的盐酸来滴定测定未知物质的量浓度的氢氧化钠溶液时,选择酚酞作指示剂.请填写下列空白:
某学生欲用已知物质的量浓度的盐酸来滴定测定未知物质的量浓度的氢氧化钠溶液时,选择酚酞作指示剂.请填写下列空白:
 Mg2+ +2OH-
Mg2+ +2OH-