题目内容
12.下列哪一个反应表示二氧化硫被还原( )| A. | SO2+2H2O+Cl2═H2SO4+2HCl | B. | SO2+H2S═2H2O+3S | ||
| C. | SO2+2NaOH═Na2SO3+H2O | D. | SO2+Na2CO3═Na2SO3+CO2↑ |
分析 在氧化还原反应中,若二氧化硫被还原,说明二氧化硫在反应中化合价降低被还原,根据各选项中S元素化合价变化进行解答.
解答 解:A.SO2+2H2O+Cl2═H2SO4+2HCl中,S元素的化合价由+4升高到+6,二氧化硫被氧化,故A错误;
B.SO2+2H2S═2H2O+3S↓中,二氧化硫中的S元素的化合价由+4降低为0,二氧化硫被还原,故B正确;
C.SO2+2NaOH═Na2SO3+H2O中,没有元素的化合价变化,则不属于氧化还原反应,故C错误;
D.反应SO2+Na2CO3═Na2SO3+CO2↑中,没有元素的化合价变化,不属于氧化还原反应,故D错误;
故选B.
点评 本题考查氧化还原反应,题目难度不大,明确二氧化硫中硫元素的化合价降低被还原是解答本题的关键,注意掌握氧化还原反应的实质与特征,试题有利于培养学生的灵活应用能力.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
2.下列过程中,没有发生化学变化的是( )
| A. | 鸡蛋清的水溶液加饱和(NH4)2SO4溶液后,有白色物质析出 | |
| B. | NO2气体经加压变成无色液体 | |
| C. | 溴水滴入植物油中振荡褪色 | |
| D. | 用SO2漂白的草帽日久变黄 |
3.新能源又称非常规能源.是指传统能源之外的各种能源形式.下列能源中不属于新能源的是( )
| A. | 风能 | B. | 煤 | C. | 太阳能 | D. | 生物质能 |
17.利用工厂废弃的合金制得氯化铝固体、硝酸铜晶体和铁红的生产流程如图,下列叙述错误的是( )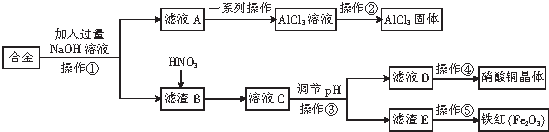

| A. | 滤液A中的溶质主要是NaAlO2和NaOH | |
| B. | 调pH时,可以加入CuO或Cu2(OH)2CO3 | |
| C. | 操作②是在蒸发皿中直接蒸干水分 | |
| D. | 该合金中含有的金属主要为铁、铜、铝 |
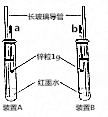 某化学兴趣小组按图示装好了实验装置,一支胶头滴管盛有盐酸,另一支胶头滴管盛有同体积、同浓度的醋酸.实验时同时完全捏扁a、b的胶头,观察实验现象.
某化学兴趣小组按图示装好了实验装置,一支胶头滴管盛有盐酸,另一支胶头滴管盛有同体积、同浓度的醋酸.实验时同时完全捏扁a、b的胶头,观察实验现象. 和一个-Cl,它的可能的结构有几种( )
和一个-Cl,它的可能的结构有几种( )