题目内容
某溶液 Mg2+.Ag+.Ba2+.三种阳离子,现用①NaOH ②Na2CO3③NaCl三种溶液使它们转化为沉淀并分离出来,要求每次只加一种溶液,滤出一种沉淀,则所加溶液顺序正确的是( )
| A、③①② | B、②③① |
| C、①③② | D、③②① |
考点:物质的检验和鉴别的基本方法选择及应用
专题:物质检验鉴别题
分析:碳酸钠溶液与溶液中Mg2+、Ag+、Ba2+均形成沉淀,则不能先加;NaCl只与Ag+反应生成沉淀;NaOH与Mg2+、Ag+反应生成沉淀,据此分析.
解答:
解:氯化钠只能与溶液中Ag+形成氯化银沉淀,然后加入的氢氧化钠只与溶液中Mg2+形成氢氧化镁沉淀,最后加入的碳酸钠与溶液中的Ba2+形成碳酸钡沉淀,满足每次只得一种沉淀的要求;则所加溶液顺序正确的是③①②;
故选A.
故选A.
点评:本题考查了离子反应,注意每次只加一种溶液、滤出一种沉淀的要求,需要考虑每次所加入的试剂只能与溶液中的一种离子形成沉淀,题目难度不大.

练习册系列答案
相关题目
某学生测定CuSO4?xH2O晶体的x值,数据如下(已知x的理论值为5.0):
产生误差的可能原因是( )
| 坩埚质量 | 坩埚+试样 | 失水后,坩埚+试样 |
| 11.70g | 20.82g | 16.02g |
| A、硫酸铜晶体中含不挥发杂质 |
| B、加热时有晶体溅出 |
| C、实验前,晶体表面有吸附水 |
| D、未做恒重操作 |
某温度时,在体积为1L的密闭容器中,A、B、C三种气体浓度的变化如图I所示,若其它条件不变,当温度分别为Tl和T2时,B的体积百分含量与时间关系如图Ⅱ所示.则下列结论正确的是( )


| A、该反应的热化学方程式为:A(g )+3B(g)?2C(g);△H>0 |
| B、达到平衡后,若其他条件不变,通入稀有气体,平衡向正反应方向移动 |
| C、达到平衡后,若其他条件不变,减小体积,平衡向逆反应方向移动 |
| D、若其它条件不变,升高温度,正、逆反应速率均增大,A的转化率减小 |
下列化学用语或模型图示正确的是( )
| A、HClO的结构式:H-Cl-O |
B、Na2O2的电子式: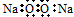 |
C、CO2的比例模型: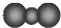 |
| D、Na原子外围电子排布式:3s1 |
下列有机物命名正确的是( )
A、 2-乙基丙烷 2-乙基丙烷 |
| B、CH3CH2CH2CH2OH 1-丁醇 |
C、 间二甲苯 间二甲苯 |
D、 2-甲基-2-丙烯 2-甲基-2-丙烯 |
下列实验设计、操作或实验现象均正确的是( )
| A、检验甲酸中是否混有甲醛,可向样品中加入足量NaOH溶液以中和HCOOH,再做银镜反应实验 |
| B、实验室制取乙酸乙酯时,将反应产生的蒸气经导管通入到饱和烧碱溶液中 |
| C、液态溴乙烷中加入AgNO3溶液观察有无淡黄色沉淀生成,以检验溴元素的存在 |
| D、实验室制硝基苯要在水浴的热水中插入温度计 |
能使干燥有色布条褪色的是( )
| A、新制氯水 | B、久置氯水 |
| C、液氯 | D、NaCl溶液 |
下列溶液中的Cl-物质的量与100ml 1mol?L-1AlCl3溶液中Cl-相等的是( )
| A、150ml 1 mol?L-1NaCl溶液 |
| B、100ml 3mol?L-1KClO3溶液 |
| C、75ml 2 mol?L-1MgCl2溶液 |
| D、50ml 1 mol?L-1FeCl3溶液 |
下列最易使酸性高锰酸钾溶液褪色的是( )
A、 |
B、 |
C、 |
D、 |