题目内容
13.下列叙述中不正确的是( )| A. | 过氧化钠是一种淡黄色固体 | |
| B. | 过氧化钠可用于呼吸面具或潜水艇中作为氧气的来源 | |
| C. | 过氧化钠与水反应后的溶液滴加几滴酚酞溶液,溶液会变为红色 | |
| D. | 1mol过氧化钠与水反应可生成1mol氧气 |
分析 A.过氧化钠是淡黄色固体;
B.过氧化钠能和二氧化碳、水反应生成氧气;
C.过氧化钠和水之间发生反应生成氢氧化钠和氧气;
D.根据过氧化钠和水反应生成氧气的方程式计算.
解答 解:A.过氧化钠是一种淡黄色固体,故A正确;
B.2Na2O2+2CO2=2Na2CO3+O2、2Na2O2+2H2O=4NaOH+O2↑,所以过氧化钠可用于呼吸面具或潜水艇中作为氧气的来源,故B正确;
C.过氧化钠和水之间发生反应生成氢氧化钠和氧气,反应后的溶液滴加酚酞,液体会变为红色,故C正确;
D.过氧化钠和水反应生成氧气,方程式为2Na2O2+2H2O=4NaOH+O2↑,则1mol过氧化钠与水反应可生成0.5mol氧气,故D错误;
故选D.
点评 本题考查了钠及其化合物的性质,根据物质的性质分析解答,熟练掌握常见元素化合物知识,题目难度不大.

练习册系列答案
相关题目
2.化学与生产、生活紧密相关,下列物质的性质和用途均正确且有因果关系的是( )
| 选项 | 性质 | 用途 |
| A | 糖类、油脂和蛋白质均能水解 | 供给人类营养 |
| B | 铁能被浓硫酸钝化 | 铁制器皿用作铜和浓硫酸的反应容器 |
| C | 碳单质的还原性强于硅单质 | 碳与石英反应冶炼粗硅 |
| D | 常温下,氨气能与氯气反应 | 浓氨水检验氯气管道泄漏 |
| A. | A | B. | B | C. | C | D. | D |
1.水煤气法制甲醇工艺流程框图如图:
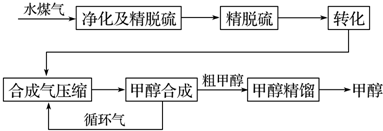
已知:除去水蒸气后的水煤气含55~59%的H2,15~18%的CO,11~13%的CO2,少量的H2S、CH4,除去H2S后,可采用催化或非催化转化技术,将CH4转化成CO,得到CO、CO2和H2的混合气体,是理想的合成甲醇原料气,即可进行甲醇合成.
(1)制水煤气的主要化学反应方程式为C(s)+H2O(g)?CO(g)+H2(g),此反应是吸热反应.
①此反应的化学平衡常数表达式为$\frac{[CO]•[{H}_{2}]}{[{H}_{2}O]}$;
②下列能提高碳的平衡转化率的措施是BC.
A加入C(s) B.加入H2O(g) C.升高温度 D.增大压强
(2)将CH4转化成CO,工业上常采用催化转化技术,其反应原理为CH4(g)+$\frac{3}{2}$O2(g)?CO(g)+2H2O(g)△H=-519kJ.工业上要选择合适的催化剂,分别对X、Y、Z三种催化剂进行如下实验(其他条件相同).
①X在T1℃时催化效率最高,能使正反应速率加快约3×105倍;
②Y在T2℃时催化效率最高,能使正反应速率加快约3×105倍;
③Z在T3℃时催化效率最高,能使逆反应速率加快约1×106倍;
已知:T1>T2>T3,根据上述信息,你认为在生产中应该选择的适宜催化剂是Z(填“X”或“Y”或“Z”),选择的理由是催化活性高、速度快、反应温度较低.
(3)合成气经压缩升温后进入10m3甲醇合成塔,在催化剂作用下,进行甲醇合成,主要反应是:2H2(g)+CO(g)?CH3OH(g)△H=-181.6kJ.4℃下此反应的平衡常数为160.此温度下,在密闭容器中加入CO、H2,反应到某时刻测得各组分的浓度如下:
①比较此时正、逆反应速率的大小:v正>v逆(填“>”、“<”或“=”).
②若加入同样多的CO、H2,在T5℃反应,10min后达到平衡,此时c(H2)=0.4mol•L-1,则该时间内反应速率v(CH3OH)=0.03mol•L-1•min-1.
(4)生产过程中,合成气要进行循环,其目的是提高原料利用率(或提高产量、产率亦可).

已知:除去水蒸气后的水煤气含55~59%的H2,15~18%的CO,11~13%的CO2,少量的H2S、CH4,除去H2S后,可采用催化或非催化转化技术,将CH4转化成CO,得到CO、CO2和H2的混合气体,是理想的合成甲醇原料气,即可进行甲醇合成.
(1)制水煤气的主要化学反应方程式为C(s)+H2O(g)?CO(g)+H2(g),此反应是吸热反应.
①此反应的化学平衡常数表达式为$\frac{[CO]•[{H}_{2}]}{[{H}_{2}O]}$;
②下列能提高碳的平衡转化率的措施是BC.
A加入C(s) B.加入H2O(g) C.升高温度 D.增大压强
(2)将CH4转化成CO,工业上常采用催化转化技术,其反应原理为CH4(g)+$\frac{3}{2}$O2(g)?CO(g)+2H2O(g)△H=-519kJ.工业上要选择合适的催化剂,分别对X、Y、Z三种催化剂进行如下实验(其他条件相同).
①X在T1℃时催化效率最高,能使正反应速率加快约3×105倍;
②Y在T2℃时催化效率最高,能使正反应速率加快约3×105倍;
③Z在T3℃时催化效率最高,能使逆反应速率加快约1×106倍;
已知:T1>T2>T3,根据上述信息,你认为在生产中应该选择的适宜催化剂是Z(填“X”或“Y”或“Z”),选择的理由是催化活性高、速度快、反应温度较低.
(3)合成气经压缩升温后进入10m3甲醇合成塔,在催化剂作用下,进行甲醇合成,主要反应是:2H2(g)+CO(g)?CH3OH(g)△H=-181.6kJ.4℃下此反应的平衡常数为160.此温度下,在密闭容器中加入CO、H2,反应到某时刻测得各组分的浓度如下:
| 物质 | H2 | CO | CH3OH |
| 浓度/mol•L-1 | 0.2 | 0.1 | 0.4 |
②若加入同样多的CO、H2,在T5℃反应,10min后达到平衡,此时c(H2)=0.4mol•L-1,则该时间内反应速率v(CH3OH)=0.03mol•L-1•min-1.
(4)生产过程中,合成气要进行循环,其目的是提高原料利用率(或提高产量、产率亦可).
8.下列有关化学用语表示正确的是( )
| A. | 中子数为3的He原子:32He | B. | HCl的电子式: | ||
| C. | S2-的结构示意图: | D. | 肼(N2H4)的结构简式:H2N-NH2 |
18.下列各组物质混合后,再加热蒸干并在300℃时充分灼烧至质量不变,最终得到纯净物的是( )
| A. | 向NaHCO3溶液中加入过量的Na2O2粉末 | |
| B. | 向KI和NaBr混合溶液中通入过量的Cl2 | |
| C. | 向NaAlO2溶液中加入过量的HCl溶液 | |
| D. | 将物质的量相同的(NH4)2SO4溶液和BaCl2溶液混合 |
5.下列离子方程式书写正确的是( )
| A. | FeCl2溶液中通入氯气:Fe2++Cl2=Fe3++2Cl- | |
| B. | FeS固体放入稀硝酸溶液中:FeS+2H+=Fe2++H2S↑ | |
| C. | 碳酸氢镁和足量的氢氧化钙溶液反应:Ca2++OH-+HCO3-=CaCO3↓+H2O | |
| D. | 向明矾溶液中滴加Ba(OH)2溶液,恰好使Al3+沉淀完全:2Al3++3SO42-+3Ba2++6OH-=2 Al(OH)3↓+3BaSO4↓ |
