题目内容
 工业上可用食盐和石灰石为主要原料,经不同的方法生产纯碱.请回答下列问题:
工业上可用食盐和石灰石为主要原料,经不同的方法生产纯碱.请回答下列问题:
(1)卢布兰法是以食盐、石灰石、浓硫酸、焦炭为原料,在高温下进行煅烧,再浸取,结晶而制得纯碱.硫酸钠和焦炭、石灰石反应的化学方程式为______(已知产物之一为CaS).
(2)氨碱法的工艺如图所示,得到的碳酸氢钠经煅烧生成纯碱.
①图中的中间产物C是______,D______ (写化学式).
②装置乙中发生反应的化学方程式为______.
解:(1)由题目信息可知,硫酸钠与石灰石、焦炭反应生成CaS、Na2CO3,根据元素守恒可知,还原C的氧化物CO或CO2生成,故反应方程式为:Na2SO4+4C+CaCO3 CaS+Na2CO3+4CO或Na2SO4+2C+CaCO3
CaS+Na2CO3+4CO或Na2SO4+2C+CaCO3  CaS+Na2CO3+2CO2,
CaS+Na2CO3+2CO2,
故答案为:Na2SO4+4C+CaCO3 CaS+Na2CO3+4CO或Na2SO4+2C+CaCO3
CaS+Na2CO3+4CO或Na2SO4+2C+CaCO3  CaS+Na2CO3+2CO2;
CaS+Na2CO3+2CO2;
(2)①碳酸钙加热分解生成CaO与CO2,故A为CaO,B为CO2,CaO在熟化桶内与水反应生成氢氧化钙,故C为Ca(OH)2;氢氧化钙与氯化铵在混合池内反应生成氨气与氯化钙,故D为NH3,
故答案为:Ca(OH)2;NH3;
②、氨气与氯化钠溶液混合后,在乙中与二氧化碳发生反应,生成NaHCO3、NH4Cl,反应方程式为NH3+CO2+NaCl+H2O=NaHCO3+NH4Cl,
故答案为:NH3+CO2+NaCl+H2O=NaHCO3+NH4Cl.
分析:(1)由题目信息可知,硫酸钠与石灰石、焦炭反应生成CaS、Na2CO3,根据元素守恒可知,还原C的氧化物CO或CO2生成;
(2)①碳酸钙加热分解生成CaO与CO2,故A为CaO,B为CO2,CaO在熟化桶内与水反应生成氢氧化钙;氢氧化钙与氯化铵在混合池内反应生成氨气与氯化钙;
②氨气与氯化钠溶液混合后,在乙中与二氧化碳发生反应,生成NaHCO3、NH4Cl.
点评:本题是对生产过程工艺的考查,需要学生细读生产工艺图中各物质的变化进行解答,难度中等.
 CaS+Na2CO3+4CO或Na2SO4+2C+CaCO3
CaS+Na2CO3+4CO或Na2SO4+2C+CaCO3  CaS+Na2CO3+2CO2,
CaS+Na2CO3+2CO2,故答案为:Na2SO4+4C+CaCO3
 CaS+Na2CO3+4CO或Na2SO4+2C+CaCO3
CaS+Na2CO3+4CO或Na2SO4+2C+CaCO3  CaS+Na2CO3+2CO2;
CaS+Na2CO3+2CO2;(2)①碳酸钙加热分解生成CaO与CO2,故A为CaO,B为CO2,CaO在熟化桶内与水反应生成氢氧化钙,故C为Ca(OH)2;氢氧化钙与氯化铵在混合池内反应生成氨气与氯化钙,故D为NH3,
故答案为:Ca(OH)2;NH3;
②、氨气与氯化钠溶液混合后,在乙中与二氧化碳发生反应,生成NaHCO3、NH4Cl,反应方程式为NH3+CO2+NaCl+H2O=NaHCO3+NH4Cl,
故答案为:NH3+CO2+NaCl+H2O=NaHCO3+NH4Cl.
分析:(1)由题目信息可知,硫酸钠与石灰石、焦炭反应生成CaS、Na2CO3,根据元素守恒可知,还原C的氧化物CO或CO2生成;
(2)①碳酸钙加热分解生成CaO与CO2,故A为CaO,B为CO2,CaO在熟化桶内与水反应生成氢氧化钙;氢氧化钙与氯化铵在混合池内反应生成氨气与氯化钙;
②氨气与氯化钠溶液混合后,在乙中与二氧化碳发生反应,生成NaHCO3、NH4Cl.
点评:本题是对生产过程工艺的考查,需要学生细读生产工艺图中各物质的变化进行解答,难度中等.

练习册系列答案
相关题目
氯碱工业中,通过电解饱和食盐水获得重要的化工原料:氯气、氢气和氢氧化钠。其中氯气用途十分广泛,除用于净水、环境消毒外,还用于生产盐酸、硅、聚氯乙烯、氯苯等。
(1)写出工业上制取盐酸的化学反应方程式:
(2)工业上可用氯气和石灰乳为原料制造漂白粉,写出漂白粉在空气中的漂白原理(用化学方程式表示) 。
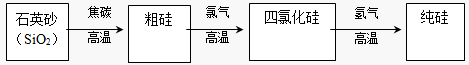
(3)工业上生产半导体材料硅的流程如下: 
①写出在制备粗硅时反应的化学方程式_____________________________,此反应中焦炭的作用是____________(填“氧化剂”或“还原剂”),若有 0.6mol硅生成,反应中转移电子的物质的量是 mol。
②粗硅与氯气反应后得到沸点较低的液态四氯化硅中常混有一些高沸点,难挥发性杂质,必须进行分离提纯。其提纯方法为____________。(填序号)
| A.蒸馏 | B.过滤 | C.萃取 | D.结晶 |
________________________________________________________________________。