题目内容
10. 698K时,向某V L的密闭容器中充入2mol H2(g)和2mol I2(g),发生反应:H2(g)+I2(g)═2HI(g),测得各物质的物质的量浓度与时间变化的关系如图所示.请回答下列问题:
698K时,向某V L的密闭容器中充入2mol H2(g)和2mol I2(g),发生反应:H2(g)+I2(g)═2HI(g),测得各物质的物质的量浓度与时间变化的关系如图所示.请回答下列问题:(1)容器的体积V=2L.
(2)反应达到最大限度的时间是5s,该时间内平均反应速率v(HI)=0.316mol•L-1•s-1
(3)判断该反应达到平衡的依据是② (填序号)
①v正(I2)=2v逆(HI)
②H2、I2、HI的浓度都不变
③容器内气体的压强保持不变
④容器内气体的密度保持不变.
分析 (1)由图可知H2(g)、I2(g)起始浓度均为1mol/L,根据V=$\frac{n}{c}$计算容器的容积;
(2)反应到达平衡时,反应混合物各组分的浓度保持不变,根据v=$\frac{△c}{△t}$计算v(HI);
(3)可逆反应到达平衡时,同种物质的正逆速率相等,各组分的浓度、含量保持不变,由此衍生的其它一些量不变,判断平衡的物理量应随反应进行发生变化,该物理量由变化到不变化说明到达平衡.
解答 解:(1)由图可知H2(g)、I2(g)起始浓度均为1mol/L,二者起始物质的量均为2mol,故容器的容积V=$\frac{2mol}{1mol/L}$=2L,故答案为:2;
(2)反应到达平衡时,反应混合物各组分的浓度保持不变,由图可知从5s起HI(g)、H2(g)、I2(g)浓度保持不变,反应到达最大限度,△c(HI)=1.58mol/L,故v(HI)=$\frac{1.58mol/L}{5s}$=0.316mol/(L.s),
故答案为:5s;0.316;
(3)①应是2v正(I2)=v逆(HI)时到达平衡状态,故①错误;
②H2、I2、HI的浓度都不变,说明反应到达平衡状态,故②正确;
③反应前后气体物质的量不变,容器内气体的压强始终保持不变,故③错误;
④混合气体总质量不变,容器容积不变,容器内气体的密度始终保持不变,故④错误,
故选:②.
点评 本题考查化学平衡计算、平衡状态判断、反应速率计算,难度不大,注意判断平衡的物理量应随反应进行发生变化,该物理量由变化到不变化说明到达平衡.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
18.关于如图各装置图的叙述中,符合实验安全且能达到实验目的是( )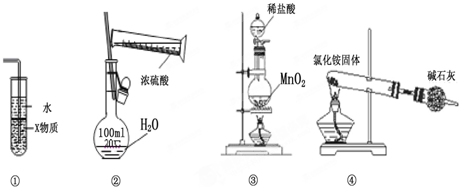

| A. | 装置中①X若为四氯化碳,则此装置可用于吸收氨气,并防止倒吸 | |
| B. | 装置②可用于实验室配制一定物质的量浓度的稀硫酸 | |
| C. | 实验室用装置③制取氯气 | |
| D. | 实验室用装置④制取氨气 |
15.反应4A(g)+5B(g)?4C(g)+6D(g),在5L的密闭容器中进行,半分钟后,C的物质的量增加了0.30mol.下列叙述正确的是( )
| A. | A的平均反应速率是0.010 mol•L-1•s-1 | |
| B. | 容器中含D物质的量至少为0.45 mol | |
| C. | 容器中A的物质的量一定增加了0.30 mol | |
| D. | 容器中A、B、C、D的物质的量的比一定是4:5:4:6 |

