题目内容
 利用反应:Cu2Cl2+C2H2+2NH3→Cu2C2(乙炔亚铜,红色)+2NH4Cl可检验乙炔.
利用反应:Cu2Cl2+C2H2+2NH3→Cu2C2(乙炔亚铜,红色)+2NH4Cl可检验乙炔.(1)基态时亚铜离子核外电子排布式为
(2)NH3中氮原子的杂化方式为
(3)乙炔分子中σ键与π键数目之比为
(4)氯化亚铜晶胞结构如下图,晶胞中含Cu+数目为
(5)合成氨工业常用铜(I)氨溶液吸收CO生成[Cu(NH3)3(CO)]+,该配离子中配体有
考点:原子核外电子排布,判断简单分子或离子的构型,配合物的成键情况,晶胞的计算,原子轨道杂化方式及杂化类型判断
专题:化学键与晶体结构
分析:(1)Cu原子失去4s能级1个电子形成亚铜离子;
(2)计算氮原子孤电子对、价层电子对数,确定杂化方式及空间构型;
(3)乙炔的结构式为H-C≡C-H,单键为σ键,三键含有1个σ键、2个π键;
原子总数相同,价电子总相同的微粒互为等电子体;
(4)Cu+位于晶胞的顶点与面心上,根据均摊法计算晶胞中Cu+数目;
(5)配合物中具有孤电子对的微粒为配体.
(2)计算氮原子孤电子对、价层电子对数,确定杂化方式及空间构型;
(3)乙炔的结构式为H-C≡C-H,单键为σ键,三键含有1个σ键、2个π键;
原子总数相同,价电子总相同的微粒互为等电子体;
(4)Cu+位于晶胞的顶点与面心上,根据均摊法计算晶胞中Cu+数目;
(5)配合物中具有孤电子对的微粒为配体.
解答:
解:(1)Cu原子失去4s能级1个电子形成亚铜离子,基态时亚铜离子核外电子排布式为为:1s22s22p63s23p63d10,
故答案为:1s22s22p63s23p63d10;
(2)NH3中氮原子氮原子价层电子对数=3+
=4,故N原子产生sp3杂化,
NH4+中N原子孤电子对数=
=0,价层电子对数=4+0=4,故其空间构型为正四面体,
故答案为:sp3杂化;正四面体;
(3)乙炔的结构式为H-C≡C-H,单键为σ键,三键含有1个σ键、2个π键,故乙炔分子中σ键与π键数目之比为3:2,与C22-互为等电子体的分子有:N2或CO等,
故答案为:3:2;N2或CO等,
(4)Cu+位于晶胞的顶点与面心上,故晶胞中Cu+数目=8×
+6×
=4,
故答案为:4;
(5)配合物中具有孤电子对的微粒为配体,[Cu(NH3)3(CO)]+配离子中配体有:NH3和CO,
故答案为:NH3和CO.
故答案为:1s22s22p63s23p63d10;
(2)NH3中氮原子氮原子价层电子对数=3+
| 5-1×3 |
| 2 |
NH4+中N原子孤电子对数=
| 5-1-1×4 |
| 2 |
故答案为:sp3杂化;正四面体;
(3)乙炔的结构式为H-C≡C-H,单键为σ键,三键含有1个σ键、2个π键,故乙炔分子中σ键与π键数目之比为3:2,与C22-互为等电子体的分子有:N2或CO等,
故答案为:3:2;N2或CO等,
(4)Cu+位于晶胞的顶点与面心上,故晶胞中Cu+数目=8×
| 1 |
| 8 |
| 1 |
| 2 |
故答案为:4;
(5)配合物中具有孤电子对的微粒为配体,[Cu(NH3)3(CO)]+配离子中配体有:NH3和CO,
故答案为:NH3和CO.
点评:本题是对物质结构的考查,涉及核外电子排布、化学键、杂化轨道、分子结构、晶胞计算、配合物等,侧重对基础知识的巩固,难度不大.

练习册系列答案
 小学课时特训系列答案
小学课时特训系列答案
相关题目
实验室欲快速制取H2,应选用正确的措施是( )
| A、纯锌与稀硫酸反应 |
| B、粗锌跟浓硫酸反应 |
| C、粗锌跟稀硝酸反应 |
| D、将浸泡过CuSO4溶液的锌跟稀硫酸反应 |
下列说法正确的是( )
| A、淀粉、蛋白质、油脂都是天然高分子化合物 |
| B、能与氢气发生加成反应的烃中一定含有碳碳双键 |
| C、煤的干馏、石油分馏、石油裂化都生成了新物质,都属于化学变化 |
| D、天然气、沼气、水煤气分别属于化石能源、可再生能源和二次能源 |




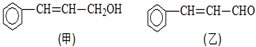

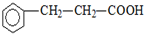 ).写出同时符合下列要求的丙的同分异构体结构简式
).写出同时符合下列要求的丙的同分异构体结构简式