题目内容
【题目】研究表明,在CuZnO2催化剂存在下,CO2和H2可发生两个平行反应,分别生成CH3OH和CO,反应的热化学方程式如下:
CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) △H1 平衡常数K1 反应Ⅰ
CH3OH(g)+H2O(g) △H1 平衡常数K1 反应Ⅰ
CO2(g)+H2(g)![]() CO(g)+H2O(g) △H2 =+41.2kJmol-1 平衡常数K2 反应Ⅱ
CO(g)+H2O(g) △H2 =+41.2kJmol-1 平衡常数K2 反应Ⅱ
(1)一定条件下,将n(CO2): n(H2)=1:1的混合气体充入绝热恒容密闭容器中发生反应。下列事实可以说明反应CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g)已达到平衡的是_______
CH3OH(g)+H2O(g)已达到平衡的是_______
A 容器内气体密度保持不变 B CO2体积分数保持不变
C 该反应的平衡常数保持不变 D 混合气体的平均相对分子质量不变
(2)研究证实,CO2也可在酸性水溶液中通过电解生成甲醇,则生成甲醇的反应的电极反应式是___________________。
(3)反应CO(g)+2H2(g)![]() CH3OH(g)的平衡常数K3=____________(用K1和K2表示)。
CH3OH(g)的平衡常数K3=____________(用K1和K2表示)。
(4)在恒压密闭容器中,由CO2和H2进行反应I合成甲醇,在其它条件不变的情况下,探究温度对化学平衡的影响,实验结果如图。

①△H1_________0(填“>”、“<”或“=”)
②有利于提高CO2平衡转化率的措施有___________(填标号)。
A.降低反应温度
B.投料比不变,增加反应物的物质的量
C.增大CO2和H2的初始投料比
D.混合气体中掺入一定量惰性气体(不参与反应)
(5)在T1温度时,将1.00molCO2和3.00molH2充入体积为1.00L的恒容密闭容器中,容器起始压强为P0,仅进行反应I。
①充分反应达到平衡后,若CO2转化率为a,则容器的压强与起始压强之比为________(用a表示)。
②若经过3h反应达到平衡,平衡后,混合气体物质的量为3.00mol,则该过程中H2的平均反应速率为____________(保留三位有效数字);平衡常数K可用反应体系中气体物质分压表示,即K表达式中用平衡分压代替平衡浓度,分压=总压×物质的量分数。写出上述反应压力平衡常数KP为____________(用P0表示,并化简)。
【答案】 BCD CO2+6e-+6H+=CH3OH+H2O K1/K2 < A 2-a/2 0.500mol·L-1·h-1 8/ P02
【解析】(1)A、密度是混合气的质量和容器容积的比值,在反应过程中质量和容积始终是不变的,所以容器内气体密度保持不变不能说明反应达到平衡状态,A错误;B、CO2体积分数保持不变说明反应达到平衡状态,B正确;C、由于是绝热容器,所该反应的平衡常数保持不变说明温度不再发生变化,反应达到平衡状态,C正确;D、混合气的平均相对分子质量是混合气的质量和混合气的总的物质的量的比值,质量不变,但物质的量是变化的,混合气体的平均相对分子质量不变说明反应达到平衡状态,D正确,答案选BCD;(2)CO2也可在酸性水溶液中通过电解生成甲醇,碳的化合降低发生还原反应,所以生成甲醇的反应发生在阴极,该电极反应式是CO2+6e-+6H+=CH3OH+H2O;(3)CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) △H1 平衡常数K1 反应Ⅰ,CO2(g)+H2(g)
CH3OH(g)+H2O(g) △H1 平衡常数K1 反应Ⅰ,CO2(g)+H2(g)![]() CO(g)+H2O(g)△H2 =+41.2kJmol-1 平衡常数K2 反应Ⅱ,所以根据盖斯定律CO(g)+2H2(g)CH3OH(g)△H3=△H1-△H2,K3=K1/K2;(4)①图中T2>T1,温度越高水蒸气的含量越少,平衡逆向移动,所以正反应是放热反应,所以△H1<0;②A.降低反应温度,平衡正向移动,CO2平衡转化率增大,A正确;B.在恒压密闭容器中,投料比不变,增加反应物的浓度,CO2平衡转化率不变,B错误;C.增大CO2和H2的初始投料比,二氧化碳转化率降低,而氢的转化率增大,C错误;D.混合气体中掺入一定量惰性气体,相当于减小压强,平衡逆向移动,二氧化碳转化率降低,C错误;答案选A。
CO(g)+H2O(g)△H2 =+41.2kJmol-1 平衡常数K2 反应Ⅱ,所以根据盖斯定律CO(g)+2H2(g)CH3OH(g)△H3=△H1-△H2,K3=K1/K2;(4)①图中T2>T1,温度越高水蒸气的含量越少,平衡逆向移动,所以正反应是放热反应,所以△H1<0;②A.降低反应温度,平衡正向移动,CO2平衡转化率增大,A正确;B.在恒压密闭容器中,投料比不变,增加反应物的浓度,CO2平衡转化率不变,B错误;C.增大CO2和H2的初始投料比,二氧化碳转化率降低,而氢的转化率增大,C错误;D.混合气体中掺入一定量惰性气体,相当于减小压强,平衡逆向移动,二氧化碳转化率降低,C错误;答案选A。
(5)① CO2(g)+3H2(g)CH3OH(g)+H2O(g)
c(初): 1 3 0 0
c(变):a 3a a a
c(平):1-a 3-3a a a
所以P0/P=4/(42a),则P/P0=(2a)/2;
②平衡后,混合气体物质的量为3.00mol,则反应的氢气的物质的量为1.5mol,v=△c/△t
=1.5mol/(1L×3h)=0.5molL-1h-1;
CO2(g)+3H2(g)CH3OH(g)+H2O(g)
c(初): 1 3 0 0
c(变): 0.5 1.5 0.5 0.5
c(平): 0.5 0.5 0.5 0.5
所以K=0.5×0.5/0.5×1.53=0.148(Lmol-1)2;因为:P/P0=1.5/2,所以P=0.75P0,p=P(H2O)P(CH3OH)/P(CO2)P3(H2)= 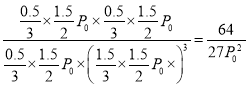 。
。

 名校课堂系列答案
名校课堂系列答案
