题目内容
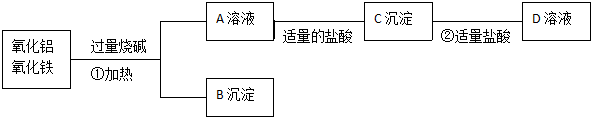
8.下列关于铁和铝的性质叙述错误的是( )| A. | 补血剂中铁元素的化合价为+2价 | |
| B. | 铝是人体中的一种微量元素,如果摄入量过多,易患老年痴呆症 | |
| C. | 铝能溶解于氢氧化钠溶液中,而铁不能与氢氧化钠溶液反应 | |
| D. | 铝的导热性比铁强,因而用铝锅煮食物比铁锅好 |
分析 A、亚铁血红蛋白输送氧气,缺铁导致营养性贫血;
B、人体内铝元素摄入量过多易患老年痴呆症;
C、铝能和氢氧化钠溶液反应,而铁不能;
D、根据铁锅中含有人体所需的铁元素进行解答.
解答 解:A、亚铁血红蛋白输送氧气,缺铁导致营养性贫血,补血剂中含有+2价铁元素,故A正确;
B.人体内铝元素摄入量过多易患老年痴呆症,故B正确;
C、铝能和氢氧化钠溶液反应,而铁不能,故C正确;
D、研究证实,长期使用铝制品作炊具可使铝摄入过量,对健康不利,还可导致老年性痴呆的发生率增加,所以,炒菜还是用铁锅好,而使用铁锅一定程度上能防止缺铁性贫血,故D错误.
故选D.
点评 本题考查Al与Fe的性质、人体营养平衡等,难度不大,注意对基础知识的掌握.

练习册系列答案
相关题目
18.下列物质不属于有机物的是( )
| A. | C2H6 | B. | C12H22O11 | C. | C6H12O6 | D. | CaCO3 |
19. 水杨酸甲酯对多种细菌的繁殖和黏附有抑制作用,也是安全、有效的植物生长调节剂.实验室制备水杨酸甲酯装置示意图和有关数据如下:
水杨酸甲酯对多种细菌的繁殖和黏附有抑制作用,也是安全、有效的植物生长调节剂.实验室制备水杨酸甲酯装置示意图和有关数据如下:
 +CH3OH$\stackrel{H+}{?}$
+CH3OH$\stackrel{H+}{?}$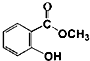 +H2O
+H2O
实验步骤:
①在干燥的三颈烧瓶中入7.0g水杨酸、30mL(0.64moL)甲醇、3mL浓H2SO4和2~3片碎瓷片,在85~95℃下加热回流(如图甲);
②1.5h后将回流装置改为蒸馏装置,水浴加热(如图乙);
③余下的反应液冷却至室温,依次用水、碳酸钠溶液和水洗涤,后再分离(如图丙);
④分出的产物加入少量无水CaCl2固体,静置片刻后过滤,
⑤对滤液蒸馏纯化,收集221~224℃馏分,得水杨酸甲酯6.1g.
⑥其它量不变,改用2mL浓H2SO4重复上述操作,得水杨酸甲酯5.5g.
回答下列问题:
(1)甲中所用三颈烧瓶应选用A
A.100mL B.150mL C.250mL D.500mL
(2)整个实验两次用到蒸馏装置,第一次用蒸馏装置的目的是:甲醇有毒,用于回收甲醇.
(3)步骤③中所用到的玻璃仪器的名称是分液漏斗、锥形瓶;
(4)本实验甲醇要过量,其目的是提高水杨酸的转化率,
(5)步骤③要进行两次水洗,如果没有进行第二次水洗,可能的后果是残留的碳酸钠与CaCl2反应生成沉淀堵塞分液漏斗,并在蒸馏时会促进水杨酸甲酯的水解.
(6)浓H2SO4的用量为3mL时,水杨酸甲酯的产率是79.2%,
(7)该实验中,浓硫酸主要表现了催化、吸水性质.
 水杨酸甲酯对多种细菌的繁殖和黏附有抑制作用,也是安全、有效的植物生长调节剂.实验室制备水杨酸甲酯装置示意图和有关数据如下:
水杨酸甲酯对多种细菌的繁殖和黏附有抑制作用,也是安全、有效的植物生长调节剂.实验室制备水杨酸甲酯装置示意图和有关数据如下:| 相对分子 质量 | 沸点/℃: | 在水中的溶解性 | |
| 甲醇 | 32 | 64.7 | 与水以任何比例相溶 |
| 水杨酸 | 138 | 211 | 0.22g/100ml |
| 水杨酸甲酯 | 152 | 222 | 0.07g/100ml |
 +CH3OH$\stackrel{H+}{?}$
+CH3OH$\stackrel{H+}{?}$ +H2O
+H2O实验步骤:
①在干燥的三颈烧瓶中入7.0g水杨酸、30mL(0.64moL)甲醇、3mL浓H2SO4和2~3片碎瓷片,在85~95℃下加热回流(如图甲);
②1.5h后将回流装置改为蒸馏装置,水浴加热(如图乙);
③余下的反应液冷却至室温,依次用水、碳酸钠溶液和水洗涤,后再分离(如图丙);
④分出的产物加入少量无水CaCl2固体,静置片刻后过滤,
⑤对滤液蒸馏纯化,收集221~224℃馏分,得水杨酸甲酯6.1g.
⑥其它量不变,改用2mL浓H2SO4重复上述操作,得水杨酸甲酯5.5g.
回答下列问题:
(1)甲中所用三颈烧瓶应选用A
A.100mL B.150mL C.250mL D.500mL
(2)整个实验两次用到蒸馏装置,第一次用蒸馏装置的目的是:甲醇有毒,用于回收甲醇.
(3)步骤③中所用到的玻璃仪器的名称是分液漏斗、锥形瓶;
(4)本实验甲醇要过量,其目的是提高水杨酸的转化率,
(5)步骤③要进行两次水洗,如果没有进行第二次水洗,可能的后果是残留的碳酸钠与CaCl2反应生成沉淀堵塞分液漏斗,并在蒸馏时会促进水杨酸甲酯的水解.
(6)浓H2SO4的用量为3mL时,水杨酸甲酯的产率是79.2%,
(7)该实验中,浓硫酸主要表现了催化、吸水性质.
3.下列变化属于物理变化的是( )
| A. | 用乙烯合成聚乙烯 | |
| B. | 分馏石油得到汽油、柴油、重油等产物 | |
| C. | 铝铁在冷、浓硫酸中钝化 | |
| D. | 食物腐败变酸 |
13.在实验室里可按图所示的装置来干燥、收集气体R,多余的气体R可用水吸收,则R是( )


| A. | HCl | B. | Cl2 | C. | NH3 | D. | CO |
20.如图是元素周期表的一部分.X、Y、Z、W均为短周期元素,Z元素原子最外层电子数是电子层数的2倍.下列说法不正确的是( )
| X | Y | ||
| Z | W |
| A. | W 的最高价氧化物的水化物酸性比Z的强 | |
| B. | 原子半径:Z>W,离子半径:Z<W | |
| C. | Y的气态氢化物可与W的气态氢化物反应生成一种离子化合物 | |
| D. | X元素形成的化合物种类最多 |
18.下列各组离子在碱性溶液中能够大量共存的是( )
| A. | Mg2+、Na+、Cl-、SO42- | B. | K+、Na+、Cl-、AlO2- | ||
| C. | Cu2+、Ca2+、Br-、I- | D. | Ba2+、K+、Cl-、HCO3- |
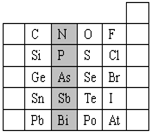 元素在周期表中的位置,反映了元素的原子结构和元素的性质.如图是元素周期表的一部分.
元素在周期表中的位置,反映了元素的原子结构和元素的性质.如图是元素周期表的一部分.