题目内容
有关化学原理的说法或比较正确的是( )
| A、对于可逆反应来说,反应物只有按等物质的量投料,其转化率才能相等 |
| B、AgCl悬浊液中存在平衡:AgCl(s)?Ag+ (aq)+Cl-(aq),往其中加入少量NaCl粉末,平衡向左移动,溶液中离子的总浓度会减小 |
| C、常温下0.1 mol/L的下列溶液 ①NH4Al(SO4)2、②NH4Cl、③NH3?H2O、④CH3COONH4中c (NH4+)由大到小的顺序是:②>①>④>③ |
| D、等浓度的下列稀溶液:①硫酸氢钠、②乙酸钠、③醋酸、④碳酸氢钠、⑤硝酸钠、⑥苯酚钠,它们的PH由小到大排列的为:①③⑤②④⑥ |
考点:难溶电解质的溶解平衡及沉淀转化的本质,化学反应的可逆性,盐类水解的原理,离子浓度大小的比较
专题:
分析:A、反应物物质的量之比按化学计量数之比投料,转化率相等;
B、溶液中含有Na+离子,离子的总浓度增大;
C、①铝离子水解抑制铵根离子的水解;②铵根离子水解;③弱碱电离,且电离的程度很弱;④醋酸根离子水解促进铵根离子水解;
D、先按照物质的类别分为碱、盐、酸进行分类,在此基础上主要考虑盐的水解,判断盐溶液的酸碱性再进行比较.
B、溶液中含有Na+离子,离子的总浓度增大;
C、①铝离子水解抑制铵根离子的水解;②铵根离子水解;③弱碱电离,且电离的程度很弱;④醋酸根离子水解促进铵根离子水解;
D、先按照物质的类别分为碱、盐、酸进行分类,在此基础上主要考虑盐的水解,判断盐溶液的酸碱性再进行比较.
解答:
解:A、反应物物质的量之比按化学计量数之比投料,转化率相等,故A错误;
B、往其中加入少量NaCl粉末,平衡向左移动,溶液中含有Na+离子,离子的总浓度增大,故B错误;
C、同浓度的下列溶液:①NH4Al(SO4)2②NH4Cl③NH3?H2O,④CH3COONH4,因①中铝离子水解抑制铵根离子的水解;②中铵根离子水解;③弱碱电离,且电离的程度很弱;④醋酸根离子水解促进铵根离子水解,则c(NH4+)由大到小的顺序是:①>②>④>③,故C错误;
D、等浓度时,①硫酸氢钠相当于一元强酸,③醋酸为一元弱酸,⑥苯酚钠、④碳酸氢钠、②乙酸钠水解都呈碱性,且水解程度依次减小,所以溶液pH⑥>④>②,⑤硝酸钾溶液呈中性,pH=7,所以溶液pH由小到大的顺序为,①③⑤②④⑥,故D正确;
故选D.
B、往其中加入少量NaCl粉末,平衡向左移动,溶液中含有Na+离子,离子的总浓度增大,故B错误;
C、同浓度的下列溶液:①NH4Al(SO4)2②NH4Cl③NH3?H2O,④CH3COONH4,因①中铝离子水解抑制铵根离子的水解;②中铵根离子水解;③弱碱电离,且电离的程度很弱;④醋酸根离子水解促进铵根离子水解,则c(NH4+)由大到小的顺序是:①>②>④>③,故C错误;
D、等浓度时,①硫酸氢钠相当于一元强酸,③醋酸为一元弱酸,⑥苯酚钠、④碳酸氢钠、②乙酸钠水解都呈碱性,且水解程度依次减小,所以溶液pH⑥>④>②,⑤硝酸钾溶液呈中性,pH=7,所以溶液pH由小到大的顺序为,①③⑤②④⑥,故D正确;
故选D.
点评:本题考查离子浓度的大小比较、pH大小比较等问题,题目难度较大,本题易错点为D项,注意先从酸碱盐角度分类,在联系盐类水解分析.

练习册系列答案
 小学课堂作业系列答案
小学课堂作业系列答案 金博士一点全通系列答案
金博士一点全通系列答案
相关题目
下列有关实验说法不正确的是( )
| A、在用简易量热计测定反应热时,可使用碎泡沫起隔热保温作用、环形玻璃搅拌棒进行搅拌使其充分反应、读取反应中温度计的最高温度、取2-3 次的实验平均值,以达到良好的实验效果 |
| B、纸上层析属于色谱分析法,其原理仅和“毛细现象”相关 |
| C、向1mL0.5mol?L-1AlCl3溶液中滴加2mL饱和NaF溶液,再滴加1mL 3.0mol?L-1 NH3?H2O溶液,无沉淀生成,说明Al3+更易与F-结合成AlF63-- |
| D、为了使过饱和溶液中析出晶体,可用玻璃棒摩擦与溶液接触处的试管壁 |
某种兴奋剂是奥运会上最早使用并最早被禁用,其结构简式如下:下列有关叙述正确的是( )


| A、该物质属于芳香族化合物,分子式为C13H12O4Cl2 |
| B、该物质分子内处于同一平面的碳原子不超过7个 |
| C、1 mol该物质最多可与5 mol H2发生加成反应 |
| D、1 mol该物质最多可与含3 mol NaOH的水溶液发生反应 |
在一定条件下,可逆反应:A(g)+3B(g)?4C(g)达到平衡时,下列叙述正确的是( )
| A、此时反应物B全部转化成了生成物 |
| B、单位时间内生成n mol A,同时生成4n mol C |
| C、若改变条件,A、B、C的浓度不可能再变化 |
| D、A、B、C的分子数比为1:3:4 |
用水稀释0.1mol/L氨水时,溶液中随水量的增加而减小的是( )
A、
| ||
B、
| ||
| C、c(H+) | ||
| D、n(OH-) |
研究反应物的化学计量数与产物之间的关系时,使用类似数轴的方法可以收到的直观形象的效果.下列表达不正确的是( )
A、密闭容器中CuO和C高温反应的气体产物: |
B、Fe在Cl2中的燃烧产物: |
C、NaOH溶液中通入一定量的CO2的产物: |
D、AlCl3溶液中滴加NaOH溶液后体系中铝元素的存在形式: |
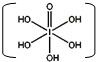 和HIO4,前者为五元酸,后者为一元酸.请比较二者酸性强弱:H5IO6
和HIO4,前者为五元酸,后者为一元酸.请比较二者酸性强弱:H5IO6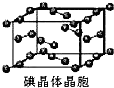 A、用均摊法可知平均每个晶胞中有4个碘原子
A、用均摊法可知平均每个晶胞中有4个碘原子