题目内容
下表为元素周期表的一部分,有关说法正确的是( )
| 族 周期 |
IA | 0 | ||||||
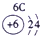
| 1 | ① | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | |
| 2 | ② | ③ | ④ | |||||
| 3 | ⑤ | ⑥ | ⑦ | ⑧ | ||||
| A、④、⑤、⑥、⑦、①的原子半径依次减小 |
| B、⑤、⑥、⑧的最高价氧化物对应的水化物不能相互反应 |
| C、⑦、②、③、④的氢化物的稳定性依次增强 |
| D、②、③的气态氢化物均能与它们的最高价氧化物对应的水化物反应 |
分析:由元素在周期表中的位置可知,①为H、②为C、③为N、④为O、⑤为Na、⑥为Al、⑦为Si、⑧为Cl,
A.同周期随原子序数增大原子半径减小,同主族自上而下原子半径增大,结合H原子半径最小解答;
B.氢氧化铝是两性氢氧化物,溶于强酸、强碱,酸与碱发生中和反应;
C.非金属性越强,其氢化物越稳定;
D.烃不能与碳酸反应.
A.同周期随原子序数增大原子半径减小,同主族自上而下原子半径增大,结合H原子半径最小解答;
B.氢氧化铝是两性氢氧化物,溶于强酸、强碱,酸与碱发生中和反应;
C.非金属性越强,其氢化物越稳定;
D.烃不能与碳酸反应.
解答:解:由元素在周期表中的位置可知,①为H、②为C、③为N、④为O、⑤为Na、⑥为Al、⑦为Si、⑧为Cl,
A.H原子半径最小,同周期随原子序数增大原子半径减小,同主族自上而下原子半径增大,故原子半径⑤>⑥>⑦>④>①,故A错误;
B.⑤、⑥、⑧的最高价氧化物对应的水化物分别为氢氧化钠、氢氧化铝、高氯酸,氢氧化铝是两性氢氧化物,溶于强酸、强碱,氢氧化钠与高氯酸发生中和反应,故B正确;
C.非金属性⑦<②<③<④,故氢化物稳定性⑦<②<③<④,故C正确;
D.氨气能与硝酸反应生成硝酸铵,但烃不能与碳酸反应,故D错误,
故选C.
A.H原子半径最小,同周期随原子序数增大原子半径减小,同主族自上而下原子半径增大,故原子半径⑤>⑥>⑦>④>①,故A错误;
B.⑤、⑥、⑧的最高价氧化物对应的水化物分别为氢氧化钠、氢氧化铝、高氯酸,氢氧化铝是两性氢氧化物,溶于强酸、强碱,氢氧化钠与高氯酸发生中和反应,故B正确;
C.非金属性⑦<②<③<④,故氢化物稳定性⑦<②<③<④,故C正确;
D.氨气能与硝酸反应生成硝酸铵,但烃不能与碳酸反应,故D错误,
故选C.
点评:本题考查元素周期表、元素周期律等,难度不大,注意整体把握元素周期表的结构、理解元素周期律.

练习册系列答案
 小学课时特训系列答案
小学课时特训系列答案
相关题目








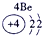
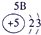
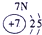
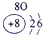
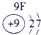
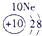
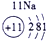





 表示的是
表示的是