题目内容
生物乙醇可由淀粉或纤维素等生物质原料发酵获得,利用乙醇可制取氢气,也可用乙醇进行相关的化工生产.
(1)已知乙醇制取氢气有如下两条路线:
a.水蒸气催化重整:CH3CH2OH(g)+H2O(g)→4H2(g)+2CO(g)
b.部分催化氧化:CH3CH2OH(g)+
O2(g)→3H2(g)+2CO(g)
原子利用率较高的是: 式(选填a或b).
(2)已知CO的燃烧热为283kJ/mol,H2的燃烧热为285.8kJ/mol.今取2mol乙醇,40%按a式制氢,60%按b式制氢,假定转化率均为100%,则两种制氢产生的全部气体完全燃烧产生的热量为 kJ.
(3)某生物质能研究所准备利用乙醇得到的合成气合成一种生物汽油.乙醇按a式和b式反应的各占50%,合成气合成生物汽油的反应为:2mCO+(2m+n)H2→2CmHn+2mH2O.假定这种生物汽油中含有X、Y两种成分,X、Y都是有8个碳原子的烃,X是苯的同系物,Y是烷烃.50吨质量分数为92%的乙醇经上述转化(假定各步转化率均为100%),则最终可得到X的质量为多少吨.
(1)已知乙醇制取氢气有如下两条路线:
a.水蒸气催化重整:CH3CH2OH(g)+H2O(g)→4H2(g)+2CO(g)
b.部分催化氧化:CH3CH2OH(g)+
| 1 |
| 2 |
原子利用率较高的是:
(2)已知CO的燃烧热为283kJ/mol,H2的燃烧热为285.8kJ/mol.今取2mol乙醇,40%按a式制氢,60%按b式制氢,假定转化率均为100%,则两种制氢产生的全部气体完全燃烧产生的热量为
(3)某生物质能研究所准备利用乙醇得到的合成气合成一种生物汽油.乙醇按a式和b式反应的各占50%,合成气合成生物汽油的反应为:2mCO+(2m+n)H2→2CmHn+2mH2O.假定这种生物汽油中含有X、Y两种成分,X、Y都是有8个碳原子的烃,X是苯的同系物,Y是烷烃.50吨质量分数为92%的乙醇经上述转化(假定各步转化率均为100%),则最终可得到X的质量为多少吨.
考点:有关反应热的计算,化学方程式的有关计算,有机化学反应的综合应用
专题:计算题
分析:(1)原子利用率=期望产物总质量与生成物的总质量之比,据此计算H原子利用率进行判断;
(2)计算CO、氢气的物质的量,再根据CO、氢气的燃烧热计算;
(3)计算乙醇物质的量,乙醇按路线①和路线②的反应各占50%,依据化学方程式,计算得到一氧化碳和氢气物质的量,合成气合成生物汽油的反应为:2mCO+(2m+n)H2→2CmHn+2mH2O,生物汽油中含有X、Y两种成分,且X、Y都是含8个碳原子的烃,X是苯的同系物为C8H10,Y是烷烃为C8H18,由O原子守恒可知n(H2O)=n(CO),令C8H10、C8H18的物质的量分别为xmol、ymol,根据碳原子守恒、H原子守恒列方程,再根据m=nM计算.
(2)计算CO、氢气的物质的量,再根据CO、氢气的燃烧热计算;
(3)计算乙醇物质的量,乙醇按路线①和路线②的反应各占50%,依据化学方程式,计算得到一氧化碳和氢气物质的量,合成气合成生物汽油的反应为:2mCO+(2m+n)H2→2CmHn+2mH2O,生物汽油中含有X、Y两种成分,且X、Y都是含8个碳原子的烃,X是苯的同系物为C8H10,Y是烷烃为C8H18,由O原子守恒可知n(H2O)=n(CO),令C8H10、C8H18的物质的量分别为xmol、ymol,根据碳原子守恒、H原子守恒列方程,再根据m=nM计算.
解答:
解:(1)a路线中,H原子利用率=
×100%=12.5%,b路线中,H原子利用率=
×100%=9.7%,则a路线原子利用率高,
故答案为:a;
(2)取2mol乙醇,40%按a式制氢,则生成CO物质的量=2mol×40%×2=1.6mol,生成氢气为2mol×40%×4=3.2mol,
60%按b式制氢,则生成CO物质的量=2mol×60%×2=2.4mol,生成氢气为2mol×60%×3=3.6mol,
CO的燃烧热为283kJ/mol,H2的燃烧热为285.8kJ/mol,则两种制氢产生的全部气体完全燃烧产生的热量为:(1.6mol+2.4mol)×283kJ/mol+(3.2mol+3.6mol)×285.8kJ/mol=3075.44kJ,
故答案为:3075.44;
(3)50 t 92%乙醇溶液中含乙醇为
=1.0×l06mol,
根据C原子守恒,得到CO总物质的量n总(CO)=1.0×l06mol×2=2.0×l06mol,
按a式得到氢气物质的量=1.0×l06mol×50%×4=2.0×l06mol,按b式反应得到氢气物质的量=1.0×l06mol×50%×3=1.5×l06mol,故n总(H2)=3.5×106mol;
合成气合成生物汽油的反应为:2mCO+(2m+n)H2→2CmHn+2mH2O,生物汽油中含有X、Y两种成分,且X、Y都是含8个碳原子的烃,X是苯的同系物为C8H10,Y是烷烃为C8H18,由O原子守恒可知n(H2O)=n(CO),
令C8H10、C8H18的物质的量分别为xmol、ymol,
根据碳原子守恒,有:8(x+y)=2.0×l06,
根据H原子守恒,有:10x+18y=3.5×106×2-2×2.0×l06,
联立方程,解得x=1.875×l05、y=6.25×l04,
故X(C8H10)的质量=1.875×l05mol×106g/mol=19.875×l06g=19.875t,
答:最终可得到C8H10的质量为19.875t.
| 4×2 |
| 46+18 |
| 3×2 |
| 46+16 |
故答案为:a;
(2)取2mol乙醇,40%按a式制氢,则生成CO物质的量=2mol×40%×2=1.6mol,生成氢气为2mol×40%×4=3.2mol,
60%按b式制氢,则生成CO物质的量=2mol×60%×2=2.4mol,生成氢气为2mol×60%×3=3.6mol,
CO的燃烧热为283kJ/mol,H2的燃烧热为285.8kJ/mol,则两种制氢产生的全部气体完全燃烧产生的热量为:(1.6mol+2.4mol)×283kJ/mol+(3.2mol+3.6mol)×285.8kJ/mol=3075.44kJ,
故答案为:3075.44;
(3)50 t 92%乙醇溶液中含乙醇为
| 50×106g×92% |
| 46g/mol |
根据C原子守恒,得到CO总物质的量n总(CO)=1.0×l06mol×2=2.0×l06mol,
按a式得到氢气物质的量=1.0×l06mol×50%×4=2.0×l06mol,按b式反应得到氢气物质的量=1.0×l06mol×50%×3=1.5×l06mol,故n总(H2)=3.5×106mol;
合成气合成生物汽油的反应为:2mCO+(2m+n)H2→2CmHn+2mH2O,生物汽油中含有X、Y两种成分,且X、Y都是含8个碳原子的烃,X是苯的同系物为C8H10,Y是烷烃为C8H18,由O原子守恒可知n(H2O)=n(CO),
令C8H10、C8H18的物质的量分别为xmol、ymol,
根据碳原子守恒,有:8(x+y)=2.0×l06,
根据H原子守恒,有:10x+18y=3.5×106×2-2×2.0×l06,
联立方程,解得x=1.875×l05、y=6.25×l04,
故X(C8H10)的质量=1.875×l05mol×106g/mol=19.875×l06g=19.875t,
答:最终可得到C8H10的质量为19.875t.
点评:本题考查反应热计算、化学方程式计算等,题目计算量大、过程比较复杂,属于易错题目,侧重考查学生分析解决问题能力的考查,难度中等.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
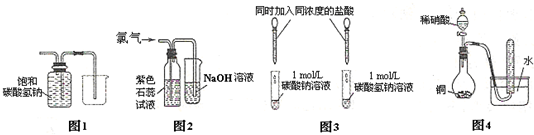
将下列物质分别注入水中,振荡后静置,能分层且浮于水面上的是( )
①溴苯;②乙酸乙酯;③乙醇;④甘油;⑤油;⑥硝基苯.
①溴苯;②乙酸乙酯;③乙醇;④甘油;⑤油;⑥硝基苯.
| A、全部 | B、①②⑤⑥ |
| C、②⑤ | D、①⑥ |
甲烷中混有乙烯,欲除去乙烯得到纯净的甲烷,依次通过的洗气瓶中盛放的试剂最好为( )
| A、澄清石灰水、浓硫酸 |
| B、KMnO4酸性溶液、浓硫酸 |
| C、溴水、浓硫酸 |
| D、浓硫酸、KMnO4酸性溶液 |
下列各项数据中,其比值为2:1的是( )
| A、Na2S溶液中c(Na+)与c(S2-)之比 |
| B、相同温度下,0.2mol/LCH3COOH溶液与0.1mol/LCH3COOH溶液中c(H+)之比 |
| C、pH等于7的氨水与硫酸铵的混合溶液中c(NH4+)与c(SO4-)之比 |
| D、pH=12的KOH溶液与pH=12的Ba(OH)2溶液中c(OH?)之比 |
用铜锌合金制成的黄铜制品常被误作黄金.下列方法不能区分其真伪的是( )
| A、观察外表 | B、放入硝酸中 |
| C、测定密度 | D、放入盐酸中 |
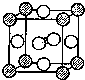 X、Y、D、E、M、N是原子序数依次增大的前四周期元素,其中X是周期表中原子半径最小的元素,Y元素基态原子的三个能级上电子数目相同,E是地壳中含量最多的元素,M是制常见不锈钢材料的第一主要合金元素,其基态原子核外的未成对电子数在同周期元素中最多,N是目前用量最大的金属元素.
X、Y、D、E、M、N是原子序数依次增大的前四周期元素,其中X是周期表中原子半径最小的元素,Y元素基态原子的三个能级上电子数目相同,E是地壳中含量最多的元素,M是制常见不锈钢材料的第一主要合金元素,其基态原子核外的未成对电子数在同周期元素中最多,N是目前用量最大的金属元素. 表示,镍原子用
表示,镍原子用 表示,镁原子用
表示,镁原子用 表示),则该晶体的化学式:
表示),则该晶体的化学式: