题目内容
把0.05mol NaOH固体分别加入下列100mL液体中,溶液的导电能力变化不大的( )
| A、自来水 |
| B、0.5 mol/L的盐酸 |
| C、0.5 mol/L的醋酸 |
| D、0.5 mol/L的NaHCO3溶液 |
考点:电解质溶液的导电性
专题:电离平衡与溶液的pH专题
分析:溶液的导电能力与自由移动离子的浓度成正比,离子浓度越大,溶液的导电能力越强,据此分析解答.
解答:
解:A.水是弱电解质,水中自由移动离子浓度很小,向水中加入氢氧化钠固体,氢氧化钠是强电解质,导致溶液中离子浓度增大,所以导电能力变化较大,故A不选;
B.盐酸是强酸,向溶液中加入氢氧化钠后,氢氧化钠和盐酸反应生成氯化钠和水,氯化钠是强电解质,所以离子浓度变化不大,所以溶液导电能力变化不大,故B选;
C.醋酸是弱电解质,溶液中离子浓度较小,氢氧化钠和醋酸反应生成醋酸钠,醋酸钠是强电解质,离子浓度增大,溶液的导电能力增大,故C不选;
D.NaHCO3溶液加NaOH,生成Na2CO3,溶液中Na+浓度增大,所以导电能力增大,故D不选;
故选B.
B.盐酸是强酸,向溶液中加入氢氧化钠后,氢氧化钠和盐酸反应生成氯化钠和水,氯化钠是强电解质,所以离子浓度变化不大,所以溶液导电能力变化不大,故B选;
C.醋酸是弱电解质,溶液中离子浓度较小,氢氧化钠和醋酸反应生成醋酸钠,醋酸钠是强电解质,离子浓度增大,溶液的导电能力增大,故C不选;
D.NaHCO3溶液加NaOH,生成Na2CO3,溶液中Na+浓度增大,所以导电能力增大,故D不选;
故选B.
点评:本题考查了溶液导电能力大小的判断,注意溶液的导电能力与离子浓度成正比,题目难度不大.

练习册系列答案
 黎明文化寒假作业系列答案
黎明文化寒假作业系列答案
相关题目
下列各组物质混合后,既有气体生成,最终又有沉淀生成的是( )
①金属钠投入到FeCl3溶液
②过量NaOH溶液和明矾溶液
③过量生石灰投入到少量饱和NH4HCO3溶液
④Na2O2投入FeCl2溶液.
①金属钠投入到FeCl3溶液
②过量NaOH溶液和明矾溶液
③过量生石灰投入到少量饱和NH4HCO3溶液
④Na2O2投入FeCl2溶液.
| A、只有① | B、只有③ |
| C、只有②③ | D、只有①③④ |
某物质含有极性共价键,则下列说法不正确的是( )
| A、可能含有离子键 |
| B、可能是无机物或有机物 |
| C、可能是单质或化合物 |
| D、不可能是金属晶体 |
下列递变情况中不正确的是( )
| A、HF、HCl、HBr、HI的沸点依次升高 |
| B、硅、磷、硫、氯元素的最高正化合价依次升高 |
| C、O2-、F-、Na+、Mg2+的离子半径依次增大 |
| D、锂、钠、钾、铷的金属性依次增强 |
设NA代表阿伏加德罗常数,下列说法正确的是( )
| A、1mol CH3+所含电子数目为6NA |
| B、7.8 g Na2O2含有阴离子数目为0.2NA |
| C、标准状况下,22.4L氯气与足量氢氧化钠溶液反应转移电子数为NA |
| D、1mol NaHSO4晶体含阳离子数为2NA |
下列关于物质“反应程度”的说法正确的是( )
| A、一定条件下,2mol SO2与足量O2反应可得到2mol SO3 |
| B、含4mol HCl的浓盐酸与足量的MnO2加热反应可制备1mol Cl2 |
| C、10mL 18.0mol/L H2SO4与足量铜加热反应可制备0.09mol SO2 |
| D、一定条件下,1mol N2与3mol H2反应可制备1.0mol NH3 |
如图是CH4、CCl4、CH3Cl的分子球棍模型图.下列说法正确的是( )
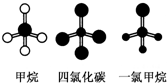

| A、CH4、CCl4和CH3Cl都是正四面体结构 |
| B、CH4、CCl4都是正四面体结构 |
| C、CH4和CCl4中的化学键完全相同 |
| D、CH4、CCl4的结构相同,性质也相同 |