��Ŀ����
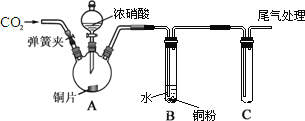
����Ŀ�������ܿ�����ָʾ���ʹ������Ʊ�����ˮ�ܿ�(��Ҫ�ɷ�ΪCo2O3��������Fe2O3��Al2O3��MnO��MgO��CaO��SiO2��)��ȡCoC2O4��2H2O������������ͼ��ʾ��
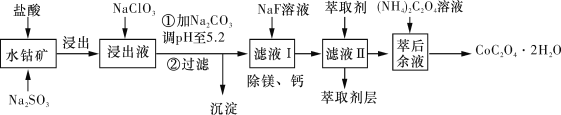
��֪���ٽ���Һ���е���������Ҫ��H����Co2+��Fe2+��Mn2+��Ca2+��Mg2+��Al3+�ȣ�
�����������£�ClO3-��������Co2+��ClO3-ת��ΪCl-��
�۲���������������������ʽ����ʱ��Һ��pH���±���
������ | Fe(OH)3 | Al(OH)3 | Co(OH)2 | Fe(OH)2 | Mn(OH)2 |
��ȫ������pH | 3.7 | 5.2 | 9.2 | 9.6 | 9.8 |
(1)���������м���Na2SO3����ҪĿ����_______________________��
(2)�����Һ�м���NaClO3�����ӷ�Ӧ����ʽ��_____________________��
(3)��֪��������NH3��H2O![]() NH4++OH-��Kb=1.8��10-5
NH4++OH-��Kb=1.8��10-5
H2C2O4![]() H��+HC2O4-��Ka1=5.4��10-2
H��+HC2O4-��Ka1=5.4��10-2
HC2O4-![]() H��+C2O42-��Ka2=5.4��10-5
H��+C2O42-��Ka2=5.4��10-5
�������������(NH4)2C2O4��Һ��pH____7 (����>������<������=��)��
(4)����(NH4)2C2O4��Һ���������壬�ٹ��ˡ�ϴ�ӣ�ϴ��ʱ��ѡ�Լ�_____(����ĸ����)��
A.����ˮ B.����ˮ C.���͵�(NH4)2C2O4��Һ D.ϡ����
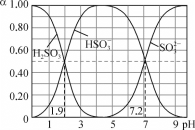
(5)��ȡ���Խ������ӵ���ȡ����pH�Ĺ�ϵ��ͼ��ʾ����ȡ���������dz�ȥ�����ӣ���ʹ�õ�����pH��Χ��_________(����ĸ����)��
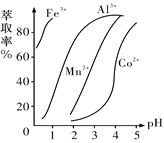
A.2.0��2.5�������� B.3.0��3.5 ������C.4.0��4.5
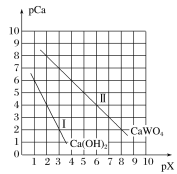
(6)CoC2O4��2H2O�ȷֽ������仯������ͼ��ʾ������600����ǰ�Ǹ����������ȣ�600���Ժ����ڿ����м��ȡ�A��B��C��Ϊ�����C����ʾ����Ļ�ѧʽ��_____________��
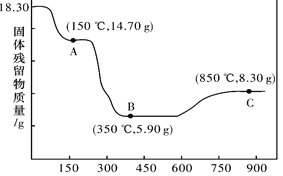
���𰸡���Co3+��ԭΪCo2+ ClO3-+6Fe2++6H+ =6Fe3++Cl-+3H2O < A B Co2O3
��������
���ܷ����м������ᣬ�ɵ�CoCl3��FeCl3��AlCl3��MnCl2��MgCl2��CaCl2����Ϣ���н���Һ���е���������Ҫ��H+��Co2+��Fe2+��Mn2+��Ca2+��Mg2+��Al3+�ȣ�������Na2SO3��Co3+��Fe3+��ԭΪCo2+��Fe2+�������������յõ������ܣ�����NaClO3��Fe2+����ΪFe3+������Na2CO3��pH��5.2���ɵõ�Fe(OH)3��Al(OH)3���������˺�������Һ��Ҫ����CoCl2��MnCl2��MgCl2��CaCl2����NaF��Һ��ȥ�ơ�þ�����˺�����Һ�м�����ȡ��������������ȡ����ȡ�����Һ����Ҫ����CoCl2������������Һ�õ������ܡ�
(1)Na2SO3��Co3+��Fe3+��ԭΪCo2+��Fe2+��
(2)NaClO3���������ԣ��ܽ�����Һ�е�Fe2+������Fe3+����������ԭ���������ӣ�ͬʱ����ˮ��
(3)���ݲ���Ķ���������ڰ�ˮ�ĵ��볣���Լ�����ˮ��Ĺ��ɷ�����
(4) (NH4)2C2O4Ϊ�������ĸ���Һ����Ҫ�Ծ������ϴ�ӣ�ϴ��ʱ�����������µ��������ӣ��ݴ˷����жϣ�
(5)��Һ�м�����ȡ���������dz�ȥ�����ӣ�pH=2��pH=3ʱCo2+����ȡ�ʱ仯����pH=3ʱMn����ȡ������ܶ࣬��pH=5ʱ��Co2+����ȡ�ʱȽϴ���ʧ���أ�
(6)��ͼ��֪��C��������������Ϊ8.30g������������Ԫ������Ϊ8.30g-5.9g=2.40g���ݴ�������������Coԭ����Oԭ�����ʵ���֮�ȣ�ȷ��Co�������ﻯѧʽ��
���ܷ����м������ᣬ�ɵ�CoCl3��FeCl3��AlCl3��MnCl2��MgCl2��CaCl2����Ϣ���н���Һ���е���������Ҫ��H+��Co2+��Fe2+��Mn2+��Ca2+��Mg2+��Al3+�ȣ�������Na2SO3��Co3+��Fe3+��ԭΪCo2+��Fe2+�������������յõ������ܣ�����NaClO3��Fe2+����ΪFe3+������Na2CO3��pH��5.2���ɵõ�Fe(OH)3��Al(OH)3���������˺�������Һ��Ҫ����CoCl2��MnCl2��MgCl2��CaCl2����NaF��Һ��ȥ�ơ�þ�����˺�����Һ�м�����ȡ��������������ȡ����ȡ�����Һ����Ҫ����CoCl2������������Һ�õ������ܡ�
(1)Na2SO3����ǿ�Ļ�ԭ�ԣ����������м���Na2SO3��Ŀ���ǽ�Co3+��Fe3+��ԭΪCo2+��Fe2+��
(2)NaClO3���������ԣ��ܽ�����Һ�е�Fe2+������Fe3+����������ԭ���������ӣ�ͬʱ����ˮ�����ӷ�Ӧ����ʽΪClO3-+6Fe2++6H+ =6Fe3++Cl-+3H2O��
(3)��������ˮ����ɣ�������ˮ�⣬˭��˭ˮ�⣬˭ǿ��˭�ԣ�NH3��H2O![]() NH4++OH-��Kb=1.8��10-5��H2C2O4
NH4++OH-��Kb=1.8��10-5��H2C2O4![]() H��+HC2O4-��Ka1=5.4��10-2 HC2O4-
H��+HC2O4-��Ka1=5.4��10-2 HC2O4-![]() H��+C2O42-��Ka2=5.4��10-5
H��+C2O42-��Ka2=5.4��10-5
����(NH4)2C2O4��Һ��笠�����ˮ����ڲ��������ˮ�⣬��Һ�����ԣ���pH<7��
(4)Ϊϴ�Ӿ��帽�ŵ����ӣ�ͬʱ�������µ��������ӣ����˻�þ���ϴ��ʱ����ֱ��ѡ������ˮϴ�ӣ��ʺ���ѡ����A��
(5)��Һ�м�����ȡ���������dz�ȥMn2+��pH=2��pH=3ʱCo2+����ȡ�ʱ仯����pH=3ʱMn2+����ȡ������ܶ࣬��pH=5ʱ��Co2+����ȡ�ʱȽϴ���ʧ���أ���pH=3ʱ��ѣ��ʺ���ѡ����B��
(6)��ͼ��֪��C��������������Ϊ8.30g��0.1molCoԪ������Ϊ5.9g������������Ԫ������Ϊ8.30g-5.9g=2.40g������������Coԭ����Oԭ�����ʵ���֮��Ϊ0.1mol��![]() ��2��3����C����ʾ��Co���ﻯѧʽΪCo2O3��
��2��3����C����ʾ��Co���ﻯѧʽΪCo2O3��