题目内容
某温度(t℃)时,水的离子积Kw=1×10-13,该温度下,若100体积pH=a的某强酸溶液与1体积pH=b的某强碱溶液混合后溶液呈中性,则混合之前,a与b之间应满足的关系是( )
| A、a+b=10 |
| B、a+b=12 |
| C、a+b=15 |
| D、a+b=16 |
考点:酸碱混合时的定性判断及有关ph的计算
专题:电离平衡与溶液的pH专题
分析:某强酸溶液与某强碱溶液混合,酸碱混合后溶液显中性,则n(H+)=n(OH-),根据c(OH-)×V碱=c(H+)×V酸计算,然后依据物质的量的关系来列式计算.
解答:
解:某温度(t℃)时,水的离子积Kw=1×10-13,该温度下,若100体积pH=a的某强酸溶液c(H+)=10-amol/L,1体积pH=b的某强碱溶液c(OH-)=
mol/L,混合后溶液呈中性,即n(H+)=n(OH-),
则100×10-a=1×10b-13,102-a=10b-13,即2-a=b-13,则a+b=15,
故选C.
| 10-13 |
| 10-b |
则100×10-a=1×10b-13,102-a=10b-13,即2-a=b-13,则a+b=15,
故选C.
点评:本题考查酸碱混合溶液为中性时酸碱的pH的关系,明确pH与氢离子和氢氧根离子的浓度的关系是解答的关键,氢氧根离子的浓度计算是易错点,题目难度中等.

练习册系列答案
相关题目
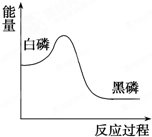 白磷在高压下隔绝空气加热后急速冷却,可得钢灰色固体黑磷,其转化过程中能量变化如图所示.下列叙述中正确的是( )
白磷在高压下隔绝空气加热后急速冷却,可得钢灰色固体黑磷,其转化过程中能量变化如图所示.下列叙述中正确的是( )| A、黑磷比白磷稳定 |
| B、黑磷与白磷互为同分异构体 |
| C、白磷转化为黑磷是氧化还原反应 |
| D、白磷转化为黑磷是吸热反应 |
下列有关使用托盘天平的叙述,不正确的是( )
①称量前先调节托盘天平的零点
②称量时左盘放被称量物,右盘放砝码
③潮湿的或有腐蚀性的药品,必须放在玻璃器皿里称量,其他固体药品可直接放在天平托盘上称量
④用托盘天平可以准确称量5.85g的固体食盐
⑤称完,应把砝码放回砝码盒中.
①称量前先调节托盘天平的零点
②称量时左盘放被称量物,右盘放砝码
③潮湿的或有腐蚀性的药品,必须放在玻璃器皿里称量,其他固体药品可直接放在天平托盘上称量
④用托盘天平可以准确称量5.85g的固体食盐
⑤称完,应把砝码放回砝码盒中.
| A、②③ | B、②④ | C、③④ | D、③ |
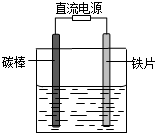 如图所示,电解未精制饱和食盐水(含有少量Mg2+),在碳棒和铁片表面均有气体生成,一段时间后铁片附近出现浑浊现象.下列叙述正确的是( )
如图所示,电解未精制饱和食盐水(含有少量Mg2+),在碳棒和铁片表面均有气体生成,一段时间后铁片附近出现浑浊现象.下列叙述正确的是( )| A、碳棒接直流电源的负极 |
| B、碳棒上发生还原反应 |
| C、铁片附近出现的浑浊物是Mg(OH)2 |
| D、铁片上的电极反应式为2Cl--2e-=Cl2↑ |
下列离子方程式中,不正确的是( )
| A、KI的酸性溶液长期置于空气中:4I-+4H++O2═2I2+2H2O |
| B、高锰酸钾酸性溶液与草酸溶液反应:2MnO4-+5C2O42-+16H+═2Mn2++10CO2↑+8H2O |
| C、用稀硫酸除去铁片表面的铁锈:FeO+2H+═Fe2++H2O |
| D、硫代硫酸钠溶液中滴加稀硫酸:2H++S2O32-═S↓+SO2↑+H2O |
在标准状况下,2.2g由CH4和C2H4组成的混合气体所占的体积为2.24L,则该混合气体中CH4和C2H4的质量比是( )
| A、1:1 | B、4:7 |
| C、7:4 | D、1:2 |
 +CH2=CH2
+CH2=CH2 CH2CH2
CH2CH2