题目内容
下列电子式,书写正确的是( )
A、 |
B、 |
C、 |
D、 |
考点:电子式
专题:
分析:A、氯化镁中镁失去2个电子分别给2个氯原子,电子式为: ;
;
B、氢氧根为阴离子,需要用中括号,且O原子满足最外层8个电子的稳定结构,H原子满足最外层2个电子的稳定结构;
C、二氧化碳中C分别与O形成2对共用电子对;
D、双氧水为共价化合物.
 ;
;B、氢氧根为阴离子,需要用中括号,且O原子满足最外层8个电子的稳定结构,H原子满足最外层2个电子的稳定结构;
C、二氧化碳中C分别与O形成2对共用电子对;
D、双氧水为共价化合物.
解答:
解:A、氯化镁中镁失去2个电子分别给2个氯原子,电子式为: ,故A错误;
,故A错误;
B、氢氧根为阴离子,需要用中括号,且O原子满足最外层8个电子的稳定结构,H原子满足最外层2个电子的稳定结构,电子式为 ,故B正确;
,故B正确;
C、二氧化碳中C分别与O形成2对共用电子对,电子式为: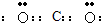 ,故C错误;
,故C错误;
D、双氧水为共价化合物,电子式为 ,故D错误,
,故D错误,
故选B.
 ,故A错误;
,故A错误;B、氢氧根为阴离子,需要用中括号,且O原子满足最外层8个电子的稳定结构,H原子满足最外层2个电子的稳定结构,电子式为
 ,故B正确;
,故B正确;C、二氧化碳中C分别与O形成2对共用电子对,电子式为:
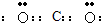 ,故C错误;
,故C错误;D、双氧水为共价化合物,电子式为
 ,故D错误,
,故D错误,故选B.
点评:判断型选择题的做法是:根据正确的书写方式判断选项是否正确.共价化合物和非金属多原子分子的电子式书写,不仅要写共用电子对还要写各原子最外层上的孤对电子.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
已知H-H键能为436KJ/mol,H-N键能为391kJ/mol,根据化学方程式:N2+3H2═2NH3 △H=-92.4kJ/mol,则N≡N键的键能是( )
| A、431 kJ/mol |
| B、945.6 kJ/mol |
| C、649 kJ/mol |
| D、869 kJ/mol |
下列有相关说法不正确的是( )
| A、某吸热反应能自发进行,因此该反应是熵增反应 |
| B、在任何条件下,纯水都呈中性 |
| C、水的离子积常数Kw随温度、外加酸(碱)浓度的改变而改变 |
| D、铅蓄电池充电时,标有“-”的电极应与电源的负极相连 |
配制250mL 1mol/L 的稀盐酸溶液,需要12mol/L的浓盐酸的体积为( )
| A、12 mL |
| B、25 mL |
| C、21 mL |
| D、12.5 mL |
在三个密闭容器中分别充入HCl、H2S、O2三种气体,当它们的温度和密度都相同时,这三种气体的压强(P)从大到小的顺序是( )
| A、P(HCl)>P(H2S)>P(O2) |
| B、P(O2)>P(H2S)>P(HCl) |
| C、P(H2S)>P(HCl)>P(O2) |
| D、P(H2S)>P(O2)>P(HCl) |
在下列物质分类中,前者包含后者的是( )
| A、氧化物、化合物 |
| B、化学反应、复分解反应 |
| C、溶液、胶体 |
| D、溶液、分散系 |
已知某无色溶液中含有K+、Cl-、SO42-三种离子,则下列离子在该溶液中可能大量存在的是( )
| A、Ba2+ |
| B、Mg2+ |
| C、Ag+ |
| D、MnO42- |
25℃时,Ksp(AgCl)=1.56×10-10,Ksp(Ag2CrO4)=9.0×10-12,下列说法正确的是( )
| A、向同浓度的Na2CrO4和NaCl混合溶液中滴加AgNO3溶液,AgCl先析出 | ||||
| B、向AgCl饱和溶液中加入NaCl晶体,有AgCl析出且溶液中 c(Ag+)=c(Cl-) | ||||
C、AgCl和Ag2CrO4共存的悬浊液中,
| ||||
| D、向Ag2CrO4的悬浊液中加入NaCl浓溶液,Ag2CrO4不可能转化为AgCl |
 .请回答下列问题:
.请回答下列问题:

 (主产物)
(主产物)