题目内容
6. 苯甲酸乙酯是一种无色透明液体、能与乙醇、乙醚混溶,不溶于水.用于配制香水香精和人造精油,其制备原理如下:
苯甲酸乙酯是一种无色透明液体、能与乙醇、乙醚混溶,不溶于水.用于配制香水香精和人造精油,其制备原理如下: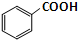 +C2H5OH$\stackrel{H_{2}SO_{4}}{?}$
+C2H5OH$\stackrel{H_{2}SO_{4}}{?}$ +H2O
+H2O已知:
| 物质 | 颜色状态 | 密度/g•cm-3 | 熔点/℃ | 沸点/℃ |
| 苯甲酸* | 白色固体 | 1.2659 | 122 | 249 |
| 苯甲酸乙酯 | 无色液体 | 1.05 | -34.6 | 212.6 |
| 乙酸 | 无色液体 | 1.0492 | 16.6 | 117.9 |
| 乙醇 | 无色液体 | 0.789 | -117.3 | 78.5 |
| 乙酸乙酯 | 无色液体 | 0.894-0.898 | -83.6 | 77.1 |
| 乙醚 | 无色液体 | 0.713 | -116.3 | 34.6 |
(1)如图1为课本上制取乙酸乙酯的实验装置图,请回答下列问题:
①乙醇、乙酸和浓硫酸混合的先后顺序乙醇、浓硫酸、乙酸(乙酸和浓硫酸的加入顺序可互换);
②浓硫酸的作用是催化剂、吸水剂;
③实验开始前在饱和碳酸钠加入酚酞,溶液会变红,随着乙酸乙酯的蒸出,红色会变浅,但是无气体产生,请写出发生该变化的离子反应方程式CH3COOH+CO32-=CH3COO-+HCO3-;
(2)按照图2所示装置制备苯甲酸乙酯.
①制备:在圆底烧瓶中加入12.20g苯甲酸、25mL乙醇(过量)、4mL浓硫酸,混合均匀并加入沸石,按图2所示连接好仪器,其中分水器的作用是分离出反应生成的水,控制温度加热回流2h.
a.实验中使用分水器不断分离除去水的目的是分离反应过程中生的水,促进酯化反应向正反应方向进行;
b.从提供的分析实验室制取苯甲酸乙酯为什么不使用制取乙酸乙酯一样的装置?如果使用制取乙酸乙酯的装置,会使乙醇大量蒸馏出去,实验效率大大降低;
②产品的提纯
将圆底烧瓶中的残液倒入盛有冷水的烧瓶中,分批加入Na2CO3溶液呈中性;用分液漏斗分出有机层得粗产品.水层用25mL乙醚萃取分液,醚层与粗产品合并;在粗产品加入无水氯化钙后,静置、过滤,过滤液进行蒸馏,蒸出乙醚后,继续升温,接收210~213℃的馏分;产品经检验合格,测得产品体积为6mL.
c.在该实验分液过程中,产物应该从分液漏斗的上口倒出(填“上口倒出”可“下口倒出”);
d.该实验中苯甲酸乙酯的产率为42%;
e.若加入的Na2CO3溶液不足,在之后的蒸馏时烧瓶内会出现白烟生成,产生该现象的原因在苯甲酸乙酯中有未除尽的苯甲酸,受热至100℃时升华.
分析 (1)①与酸混合时,将密度大的液体注入密度小的液体中,混合浓硫酸和乙醇时,应将浓硫酸慢慢注入到乙醇中,并不断搅拌,使产生的热量及时散失;
②乙酸与乙醇需浓硫酸作催化剂,该反应为可逆反应,浓硫酸吸水利于平衡向生成乙酸乙酯方向移动;
③随着乙酸乙酯的蒸出,红色会变浅,但是无气体产生,是因为碳酸钠与醋酸反应生成碳酸氢根离子,酸性减弱;
(2)①a.使用分水器不断分离除去水,促进反应正向进行,生成酯的产率增大;
b.依据装置中反应物挥发出,反应物减小导致反应物的利用率降低分析;
c.根据分流漏斗的使用方法可知,下层液体从下口放出,上层液体从上层倒出,苯甲酸乙酯的密度小于水,据此判断;
d.实验的产率=$\frac{实际产量}{理论产量}$×100%;
e.若加入的Na2CO3溶液不足,在之后的蒸馏时烧瓶内会出现的白烟是固体小颗粒,可能是苯甲酸乙酯中混有未除净的苯甲酸.
解答 解:(1)①浓硫酸溶于水放出大量的热,乙醇中含有少量水,应将浓硫酸加入到乙醇中,防止硫酸溶解时放出大量的热导致液体飞溅,则加入药品的顺序为先在大试管中注入乙醇,再分别缓缓加入浓硫酸和乙酸(乙酸和浓硫酸的加入顺序可互换),边加边振荡试管使之混合均匀,即加入顺序为乙醇、浓硫酸、乙酸(乙酸和浓硫酸的加入顺序可互换),
故答案为:乙醇、浓硫酸、乙酸(乙酸和浓硫酸的加入顺序可互换);
②乙酸与乙醇需浓硫酸作催化剂,该反应为可逆反应,浓硫酸吸水利于平衡向生成乙酸乙酯方向移动.故浓硫酸的作用为催化剂,吸水剂,
故答案为:催化剂、吸水剂;
③碳酸钠为强碱弱碱盐,碳酸根离子水解呈碱性,实验开始前在饱和碳酸钠加入酚酞,溶液会变红,随着乙酸乙酯的蒸出,发生反应:CH3COOH+CO32-=CH3COO-+HCO3-,碳酸根离子浓度减小,碱性减弱,所以红色会变浅,但是无气体产生,
故答案为:CH3COOH+CO32-=CH3COO-+HCO3-;
(2)①a.酯化反应是可逆反应,使用分水器不断分离除去水,促进酯化反应正反应方向进行,提高生成酯的产量,
故答案为:分离反应过程中生的水,促进酯化反应向正反应方向进行;
b.如果使用制取乙酸乙酯的装置,反应过程中加热,会使乙醇大量蒸馏出去,乙醇挥发混入酯中,降低反应物的利用率,实验效率大大降低,
故答案为:如果使用制取乙酸乙酯的装置,会使乙醇大量蒸馏出去,实验效率大大降低;
c.分流漏斗,下层液体从下口放出,上层液体从上层倒出,苯甲酸乙酯的密度小于水,所以有机层从下口放出,
故答案为:上口倒出;
d.12.20g苯甲酸的物质的量为:n=$\frac{m}{M}$=$\frac{12.20g}{122g/mol}$=0.1mol,理论生成的苯甲酸乙酯的质量为0.1×150g=15g,而实际生成苯甲酸乙酯的质量为:6mL×1.05g•ml-1=6.3g,所以实验的产率=$\frac{6.3g}{15g}$×100%=42%,
故答案为:42%;
e.加入Na2CO3能与未反应的苯甲酸和硫酸,可以除去未反应的苯甲酸和硫酸,白烟是固体小颗粒,因为苯甲酸在100℃会迅速升华,所以可能是苯甲酸乙酯中混有未除净的苯甲酸,
故答案为:在苯甲酸乙酯中有未除尽的苯甲酸,受热至100℃时升华.
点评 本题考查了物质制备方案的设计,题目难度中等,明确制备原理为解答关键,试题涉及酯化反应原理、化学实验基本操作方法、产率的计算、化学平衡的影响因素等知识,注意掌握物质制备方案的设计及评价原则,试题充分考查了学生的分析能力及灵活应用基础知识的能力.

 阅读快车系列答案
阅读快车系列答案 图是实验室制乙酸乙酯的装置.
图是实验室制乙酸乙酯的装置.(1)加热前,通常需要在试管Ⅰ中加入碎瓷片,目的是防止暴沸.
(2)为了证明浓硫酸的作用,某同学进行了以下4个实验,实验记录如表:
| 实验 编号 | 试管Ⅰ中试剂 | 试管Ⅱ中试剂 | 有机层厚度/cm |
| A | 3mL乙醇、2mL乙酸、1mL18mol•L-1浓硫酸 | 饱和Na2CO3溶液 | 5.0 |
| B | 3mL乙醇、2mL乙酸 | 饱和Na2CO3溶液 | 0.1 |
| C | 3mL乙醇、2mL乙酸、6mL3mol•L-1硫酸 | 饱和Na2CO3溶液 | 1.2 |
| D | 3mL乙醇、2mL乙酸、6mL6mol•L-1盐酸 | 饱和Na2CO3溶液 | 1.2 |
②分析实验A、B、C的数据,可以得出浓硫酸在反应中的作用是催化剂、吸水剂;实验D和实验C对照,你又能得出的结论是对该反应起催化作用的实际上为H+.
(3)饱和Na2CO3溶液的作用是中和乙酸、溶解乙醇、降低酯在水中的溶解度,容易分层.
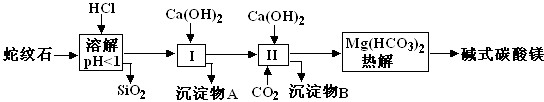
(1)蛇纹石矿加盐酸溶解后,溶液里除了Mg2+外,还含有的金属离子是Fe3+、Al3+(填离子符号).
(2)进行Ⅰ操作时,控制溶液的pH=7-8(有关氢氧化物沉淀的pH见下表)Ca(OH)2不能过量,若Ca(OH)2过量可能会导致Al(OH)3(填化学式,下同)溶解、,Mg(OH)2沉淀.
| 氢氧化物 | Fe(OH)3 | Al(OH)3 | Mg(OH)2 |
| 开始沉淀pH | 2.3 | 3.3 | 9.4 |
(4)物质循环使用,能节约资源.上述实验中,可以循环使用的物质是CaCO3或CO2.
(5)现设计一个实验,确定产品aMgCO3•bMg(OH)2•cH2O中a、b、c的值,请完成下列实验步骤(可用试剂:浓硫酸、碱石灰):
Ⅰ.①称量样品,②高温分解,③用浓硫酸吸收水蒸气,④称量碱石灰吸收CO2前后的质量,⑤称出MgO.
Ⅱ.18.2g产品完全分解后,产生6.6gCO2和8.0gMgO,由此可知,产品的化学式中:a=3,b=1,c=3.
| A. | A是固体,C是气体,正反应吸热 | B. | A是气体,C是气体,正反应放热 | ||
| C. | A是气体,C是固体,正反应放热 | D. | A是气体,C是气体,正反应吸热 |
| A. | 相对分子质量M=$\frac{22.4mw}{(1-w)V}$ | B. | 物质的量浓度c=$\frac{1000ρv}{Mv+22.4}$ | ||
| C. | 质量分数w=$\frac{Mv}{22.4m}$ | D. | 溶液密度ρ=$\frac{cM}{1000w}$ |
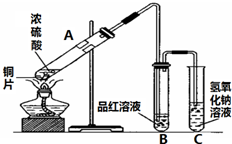 图是进行铜与浓硫酸反应并进行产物检验的装置.
图是进行铜与浓硫酸反应并进行产物检验的装置. “酒是陈的香”,就是因为酒在储存过程中生成了有香味的乙酸乙酯,在实验室我们也可以用如图所示的装置制取乙酸乙酯.回答下列问题:
“酒是陈的香”,就是因为酒在储存过程中生成了有香味的乙酸乙酯,在实验室我们也可以用如图所示的装置制取乙酸乙酯.回答下列问题:
