题目内容
(1)相同质量的SO2和SO3的物质的量比为______.
(2)相同物质的量的O2和O3的质量比为______,在同温同压下的密度之比为______.
(3)某化学兴趣小组对“农夫山泉”矿泉水进行检测时,发现1.0L该矿泉水中含有48mg Mg2+,该矿泉水中Mg2+的物质的量浓度为______.
(4)标准状况下O3和CO2的混合气体3.36L,其质量为6.9g,该混合气体的平均摩尔质量为______,混合气体中C、O原子个数比为______.
解:(1)令SO2和SO3的质量都为1g,SO2的物质的量为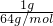 =
=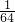 mol,SO3的物质的量为
mol,SO3的物质的量为 =
= mol,
mol,
所以相同质量的SO2和SO3的物质的量之比为: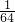 mol:
mol: mol=5:4,
mol=5:4,
故答案为:5:4;
(2)根据m=nM可知,物质的量相同,质量之比等于摩尔质量之比,故相同物质的量的O2和O3的质量比为32g/mol:48g/mol=2:3,
同温同压下的密度之比等于摩尔质量之比为32g/mol:48g/mol=2:3,
故答案为:2:3;2:3;
(3)48mgMg2+的物质的量为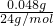 =0.002mol,所以Mg2+的浓度为
=0.002mol,所以Mg2+的浓度为 =0.002mol/L,
=0.002mol/L,
故答案为:0.002mol/L;
(4)标准状况下,混合气体的物质的量为: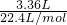 =0.15mol,
=0.15mol,
故混合气体的平均摩尔质量为: =46g/mol;
=46g/mol;
设O3的物质的量为x,CO2的物质的量为y,则:

解得:x=0.075mol,y=0.075mol,
混合气体中C、O原子个数比为0.075mol:(0.075mol×2+0.075mol×3)=1:5,
故答案为:46g/mol;1:5.
分析:(1)令SO2和SO3的质量都为1g,根据n= 计算二者的物质的量,据此计算二者物质的量之比;
计算二者的物质的量,据此计算二者物质的量之比;
(2)根据m=nM可知,物质的量相同,质量之比等于摩尔质量之比;
同温同压下的密度之比等于摩尔质量之比;
(3)根据n= 计算48mgMg2+的物质的量,再根据c=
计算48mgMg2+的物质的量,再根据c= 计算Mg2+的浓度;
计算Mg2+的浓度;
(4)根据n= 计算混合气体的总的物质的量,利用M=
计算混合气体的总的物质的量,利用M= 计算混合气体的平均摩尔质量;
计算混合气体的平均摩尔质量;
设O3的物质的量为x,CO2的物质的量为y,根据质量之和与物质的量之和列式计算可求得气体的物质的量,进而计算C原子、O原子的物质的量,据此计算.
点评:本题考查常用化学计量有关计算、阿伏伽德罗定律及推论、混合物的有关计算等,题目难度不大,注意相关计算公式的运用,(4)通过平均相对分子质量利用十字交叉法计算二者的物质的量之比更简单.
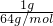 =
=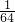 mol,SO3的物质的量为
mol,SO3的物质的量为 =
= mol,
mol,所以相同质量的SO2和SO3的物质的量之比为:
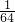 mol:
mol: mol=5:4,
mol=5:4,故答案为:5:4;
(2)根据m=nM可知,物质的量相同,质量之比等于摩尔质量之比,故相同物质的量的O2和O3的质量比为32g/mol:48g/mol=2:3,
同温同压下的密度之比等于摩尔质量之比为32g/mol:48g/mol=2:3,
故答案为:2:3;2:3;
(3)48mgMg2+的物质的量为
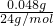 =0.002mol,所以Mg2+的浓度为
=0.002mol,所以Mg2+的浓度为 =0.002mol/L,
=0.002mol/L,故答案为:0.002mol/L;
(4)标准状况下,混合气体的物质的量为:
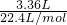 =0.15mol,
=0.15mol,故混合气体的平均摩尔质量为:
 =46g/mol;
=46g/mol;设O3的物质的量为x,CO2的物质的量为y,则:

解得:x=0.075mol,y=0.075mol,
混合气体中C、O原子个数比为0.075mol:(0.075mol×2+0.075mol×3)=1:5,
故答案为:46g/mol;1:5.
分析:(1)令SO2和SO3的质量都为1g,根据n=
 计算二者的物质的量,据此计算二者物质的量之比;
计算二者的物质的量,据此计算二者物质的量之比;(2)根据m=nM可知,物质的量相同,质量之比等于摩尔质量之比;
同温同压下的密度之比等于摩尔质量之比;
(3)根据n=
 计算48mgMg2+的物质的量,再根据c=
计算48mgMg2+的物质的量,再根据c= 计算Mg2+的浓度;
计算Mg2+的浓度;(4)根据n=
 计算混合气体的总的物质的量,利用M=
计算混合气体的总的物质的量,利用M= 计算混合气体的平均摩尔质量;
计算混合气体的平均摩尔质量;设O3的物质的量为x,CO2的物质的量为y,根据质量之和与物质的量之和列式计算可求得气体的物质的量,进而计算C原子、O原子的物质的量,据此计算.
点评:本题考查常用化学计量有关计算、阿伏伽德罗定律及推论、混合物的有关计算等,题目难度不大,注意相关计算公式的运用,(4)通过平均相对分子质量利用十字交叉法计算二者的物质的量之比更简单.

练习册系列答案
 永乾教育寒假作业快乐假期延边人民出版社系列答案
永乾教育寒假作业快乐假期延边人民出版社系列答案
相关题目
某CuSO4、Fe2(SO4)3、H2SO4的混合溶液100 mL,已知溶液中阳离子的浓度相同,且SO的物质的量浓度为6 mol·L-1,则此溶液最多溶解铁粉的质量为
| A.5.6 g |
| B.11.2 g |
| C.22.4 g |
| D.33.6 g |
 的浓度为
的浓度为