题目内容
工业制硝酸的主要反应是:4NH3(g)+5O2(g)?4NO(g)+6H2O (g)△H=-1025KJ/mol
(1)一定温度下,现将0.8mol NH3和1.5mol O2充入一恒压密闭容器中,下列示意图正确且能说明反应达到平衡状态的是 .

(2)在容积为1L的密闭容器中发生上述反应,容器内部分物质的物质的量浓度如下表:
①起始时物料比c (O2):c (NH3)>1.25,其原因是 .
②反应在第2min到第4min时O2的平均反应速率为 mol?L-1?min-1.
③反应在第2min改变了反应条件,改变的条件可能是 (填字母序号).
a.使用催化剂 b.升高温度 c.增大压强 d.增加O2的浓度
④反应在第8min改变的反应条件可能是 ,再次达到平衡时,NO的体积分数 (填“增大”、“减小”或“不变”).
(1)一定温度下,现将0.8mol NH3和1.5mol O2充入一恒压密闭容器中,下列示意图正确且能说明反应达到平衡状态的是

(2)在容积为1L的密闭容器中发生上述反应,容器内部分物质的物质的量浓度如下表:
| 时间/浓度 | c(NH3)(mol/L) | C(O2)(mol/L) | C(NO)(mol/L) |
| 起始 | 0.8 | 1.5 | 0 |
| 第2min | 0.7 | a | 0.1 |
| 第4min | 0.4 | 1.0 | 0.4 |
| 第6min | 0.4 | 1.0 | 0.4 |
| 第8min | 1.2 | 2.5 | 0.4 |
②反应在第2min到第4min时O2的平均反应速率为
③反应在第2min改变了反应条件,改变的条件可能是
a.使用催化剂 b.升高温度 c.增大压强 d.增加O2的浓度
④反应在第8min改变的反应条件可能是
考点:化学平衡的影响因素,化学平衡建立的过程,化学平衡状态的判断
专题:化学平衡专题
分析:(1)根据达到平衡状态,各组分浓度不变,正逆反应速率相等进行判断;
(2)①根据增加一种物质的浓度,可以提高另一种物质的转化率;
②先根据速率公式求出NO的速率,然后根据速率之比等于化学计量数之比求出O2的速率;
③根据表可知第2min是平衡建立过程,反应速率加快,氧气的量没有增加,根据外界条件对化学反应速率的影响;
④根据改变瞬间生成物的浓度不变,反应物的浓度增大;再次达到平衡时,NO的体积分数减小.
(2)①根据增加一种物质的浓度,可以提高另一种物质的转化率;
②先根据速率公式求出NO的速率,然后根据速率之比等于化学计量数之比求出O2的速率;
③根据表可知第2min是平衡建立过程,反应速率加快,氧气的量没有增加,根据外界条件对化学反应速率的影响;
④根据改变瞬间生成物的浓度不变,反应物的浓度增大;再次达到平衡时,NO的体积分数减小.
解答:
解:(1)a.反应方程式两边气体的质量不相等,密度不变,说明达到了平衡状态,故a正确;
b.反应过程中,反应热不会变化,不是变量,无法判断是否达到平衡状态,故b错误;
c.一氧化氮和氨气的速率不等,故c错误;
d.氨气的转化率不变,说明正逆反应速率相等,达到了平衡状态,故d正确;
故答案为:ad;
(2)①因增加一种物质的浓度,可以提高另一种物质的转化率,所以合成氨中往往增加氧气的浓度来提高氨气的转化率,
故答案为:增大氨气的转化率;
②第2min到第4min时NO的平均反应速率
=0.15mol/L?min,V(O2)=
V(NO)=0.15×
=0.1875mol/L?min,
故答案为:0.1875;
③根据表可知第2min是平衡建立过程,反应速率加快,氧气的量没有增加,根据外界条件对化学反应速率的影响,可知使用催化剂、升高温度均可,增加02的浓度是不可,增大压强会使的各物质浓度增大,也不可,
故答案为:ab;
④因改变瞬间生成物的浓度不变,反应物的浓度增大,所以只能通过增大NH3和02的浓度来达到,再次达到平衡时,NO的体积分数减小,
故答案为:增大反应物的浓度;减小.
b.反应过程中,反应热不会变化,不是变量,无法判断是否达到平衡状态,故b错误;
c.一氧化氮和氨气的速率不等,故c错误;
d.氨气的转化率不变,说明正逆反应速率相等,达到了平衡状态,故d正确;
故答案为:ad;
(2)①因增加一种物质的浓度,可以提高另一种物质的转化率,所以合成氨中往往增加氧气的浓度来提高氨气的转化率,
故答案为:增大氨气的转化率;
②第2min到第4min时NO的平均反应速率
| 0.7-0.4 |
| 4-2 |
| 5 |
| 4 |
| 5 |
| 4 |
故答案为:0.1875;
③根据表可知第2min是平衡建立过程,反应速率加快,氧气的量没有增加,根据外界条件对化学反应速率的影响,可知使用催化剂、升高温度均可,增加02的浓度是不可,增大压强会使的各物质浓度增大,也不可,
故答案为:ab;
④因改变瞬间生成物的浓度不变,反应物的浓度增大,所以只能通过增大NH3和02的浓度来达到,再次达到平衡时,NO的体积分数减小,
故答案为:增大反应物的浓度;减小.
点评:本题主要考查了的知识点较多,涉及到平衡状态的判断,化学反应速率的计算,外界条件对平衡的影响,难度中等.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
下列物质中,用乙烯作原料通过一步反应不能得到的是( )
| A、CH3CH2Cl |
| B、CH2=CHCl |
| C、CH3CH2OH |
| D、CH2Br-CH2Br |
化学与能源开发、环境保护、资源利用、食品安全等密切相关.下列说法正确是( )
| A、自来水生产中应尽量用明矾净化、消毒 |
| B、高纯硅及其氧化物在太阳能电池及信息高速传输中有重要应用 |
| C、PM2.5是指大气中直径接近于2.5×10-6m的颗粒物,也称细颗粒物,这些细颗粒物分散在空气中形成混合物具有丁达尔效应 |
| D、绿色化学的核心是利用化学反应原理治理环境污染 |
 室温下,单质A、B、C分别为银白色固体、黄绿色气体、无色气体,且A在空气中燃烧会变成淡黄色粉末.在合适的反应条件下,它们可以按下面框图进行反应,且E溶液是无色的.请据图回答:
室温下,单质A、B、C分别为银白色固体、黄绿色气体、无色气体,且A在空气中燃烧会变成淡黄色粉末.在合适的反应条件下,它们可以按下面框图进行反应,且E溶液是无色的.请据图回答: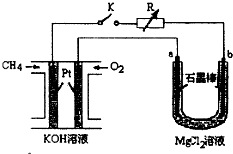 新型高效的甲烷燃料电池采用铂为电极材料,两电极上分别通入 CH4和 O2,电解质为 KOH 溶液.某研究小组将甲烷燃料电 池作为电源进行氯化镁溶液龟解实验,电解装置如图所示.
新型高效的甲烷燃料电池采用铂为电极材料,两电极上分别通入 CH4和 O2,电解质为 KOH 溶液.某研究小组将甲烷燃料电 池作为电源进行氯化镁溶液龟解实验,电解装置如图所示.