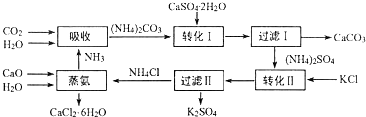
题目内容
4.在一定条件下,RO3-与R-可发生反应:RO3-+5R-+6H+═3R2+3H2O,下列关于R元素的叙述中,正确的是( )| A. | 元素R位于周期表中第ⅤA族 | |
| B. | R只能被还原 | |
| C. | R2在常温常压下一定是气体 | |
| D. | 若1mol RO3-参与该反应,则转移的电子的物质的量为5 mol |
分析 A、由反应方程式可知,R的最低负价为-1,则其最高正价为+7价,族序数等于最高正化合价.
B、R2中R为0价,R的最低负价为-1,R最高正价为+7价,元素处于中间价态既具有氧化性又具有还原性.
C、若R为I或Br也可以发生如上反应.
D、反应中R元素化合价由+5价降低为0,据此计算.
解答 解:A、由反应方程式可知,R的最低负价为-1,则其最高正价为+7价,族序数等于最高正化合价,元素R应位于第ⅦA族,故A错误;
B、R2中R为0价,R的最低负价为-1,R最高正价为+7价,元素处于中间价态既具有氧化性又具有还原性,故B错误;
C、若R为Cl,单质为气体,若R为I或Br也可以发生如上反应,碘为固体,溴为液体,故C错误;
D、反应中R元素化合价由+5价降低为0,若1molRO3-参与该反应,则转移的电子的物质的量为1mol×(5-0)=5mol,故D正确.
故选:D.
点评 本题考查氧化还原反应及元素的位置和性质,正确判断元素是解题的关键.只有注意结合隐含条件,才能正确判断出元素.

练习册系列答案
相关题目
14.下列元素中,原子半径最小的是( )
| A. | Li | B. | Na | C. | F | D. | Cl |
19.硅是重要的半导体材料,构成了现代电子工业的基础.回答下列问题.
(1)单质硅可通过甲硅烷(SiH4)分解反应来制备.工业上采用Mg2Si和NH4Cl在液氨介质中反应制得SiH4,该反应的化学方程式为Mg2Si+4NH4Cl═SiH4+4NH3+2MgCl2.
(2)碳和硅的有关化学键键能如下所示,简要分析和解释下列有关事实:
①硅与碳同族,也有系列氢化物,但硅烷在种类和数量上都远不如烷烃多,原因是C-C键和C-H键较强,所形成的烷烃稳定.而硅烷中Si-Si键和Si-H键的键能较低,易断裂,导致长链硅烷难以生成.
②SiH4的稳定性小于CH4,更易生成氧化物,原因是C-H键的键能大于C-O键,C-H键比C-O键稳定.而Si-H键的键能却远小于Si-O键,所以Si-H键不稳定而倾向于形成稳定性更强的Si-O键.
(3)在硅酸盐中,SiO${\;}_{4}^{4-}$四面体[如图(a)]通过共用顶角氧离子可形成岛状、链状、层状、骨架网状四大类结构型式.图(b)为一种无限长单链结构的多硅酸根,其中Si与O的原子数之比为1:3.

(1)单质硅可通过甲硅烷(SiH4)分解反应来制备.工业上采用Mg2Si和NH4Cl在液氨介质中反应制得SiH4,该反应的化学方程式为Mg2Si+4NH4Cl═SiH4+4NH3+2MgCl2.
(2)碳和硅的有关化学键键能如下所示,简要分析和解释下列有关事实:
| 化学键 | C-C | C-H | C-O | Si-Si | Si-H | Si-O |
| 键能 (kJ•mol-1) | 356 | 413 | 336 | 226 | 318 | 452 |
②SiH4的稳定性小于CH4,更易生成氧化物,原因是C-H键的键能大于C-O键,C-H键比C-O键稳定.而Si-H键的键能却远小于Si-O键,所以Si-H键不稳定而倾向于形成稳定性更强的Si-O键.
(3)在硅酸盐中,SiO${\;}_{4}^{4-}$四面体[如图(a)]通过共用顶角氧离子可形成岛状、链状、层状、骨架网状四大类结构型式.图(b)为一种无限长单链结构的多硅酸根,其中Si与O的原子数之比为1:3.

9.如表所示,为提纯下列物质(括号内为杂质),所用的除杂试剂和分离方法都正确的是( )
| 序号 | 不纯物 | 除杂试剂 | 分离方法 |
| A | CH4(C2H4) | 酸性KMn04溶液 | 洗气 |
| B | NH4Cl溶液(FeCl3) | NaOH溶液 | 过滤 |
| C | 福尔马林(甲酸) | Na2CO3溶液 | 蒸馏 |
| D | 苯(苯酚) | 溴 水 | 分液 |
| A. | A | B. | B | C. | C | D. | D |
16.下列各图中,表示吸热反应的是( )
| A. |  | B. |  | C. |  | D. |  |
13.CH3CH2CH2CH3(正丁烷)和CH(CH2) 3(异丁烷)互为 ( )
| A. | 同分异构体 | B. | 同位素 | C. | 同素异形体 | D. | 同系物 |
 .
.