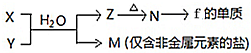题目内容
2.某CuSO4、Fe2(SO4)3、H2SO4的混合溶液100mL,已知溶液中阳离子的浓度相等,且SO42-的物质的量浓度为9mol/L,则此溶液最多溶解Mg的质量为( )| A. | 24g | B. | 18g | C. | 21.6g | D. | 25.2g |
分析 足量的Mg与CuSO4、Fe2(SO4)3、H2SO4的混合溶液反应最终得到MgSO4,由元素守恒可知,可知n(Mg)=n(MgSO4)=n(SO42-),再根据m=nM计算Mg的质量.
解答 解:足量的Mg与CuSO4、Fe2(SO4)3、H2SO4的混合溶液反应最终得到MgSO4,由元素守恒可知,可知n(Mg)=n(MgSO4)=n(SO42-)=0.1L×9mol/L=0.9mol,故最多溶解Mg的质量=0.9mol×24g/mol=21.6g,故选C.
点评 本题考查化学方程式有关计算,难度中等,关键是明确足量的Mg与硫酸铁反应得到Fe,注意利用守恒思想解答,简化计算步骤.

练习册系列答案
相关题目
11.取一定质量的镁铝合金粉末,投入到过量的NaOH溶液中,充分反应后过滤,向等滤液中通入足量CO2气体,滤出沉淀,洗涤、干燥、灼烧,冷却后称量固体的质量与原合金质量相等.则合金中镁的质量分数为( )
| A. | 65.4% | B. | 52.9% | C. | 47.1% | D. | 34.6% |
13.有关合金的叙述错误的是( )
| A. | 铁与非金属氯、氧很难形成合金 | B. | 合金是混合物 | ||
| C. | 形成合金后,其熔点要提高 | D. | 形成合金后,其硬度要增大 |
17.已知:①向KMnO4晶体滴加浓盐酸,产生黄绿色气体;②向FeCl2溶液中通入少量实验①产生的气体,溶液变黄色.下列判断正确的是( )
| A. | 上述实验证明氧化性:MnO4->Cl2>Fe3+ | |
| B. | 上述实验中,有一个氧化还原反应 | |
| C. | 实验①生成的气体需要进行尾气处理 | |
| D. | 实验②证明Fe2+既有氧化性又有还原性 |
7.品红分子结构中的发色基团遇到SO2与水形成的亚硫酸后结构发生改变,生成不稳定的无色化合物.亚硫酸漂白原理可用下面的反应方程式表示:

下列说法正确的是( )

下列说法正确的是( )
| A. | 品红的分子式为C20H18N3 | |
| B. | 上述漂白原理反应属加成反应 | |
| C. | 碱性品红及与H2SO3生成的无色化合物都可与NaOH溶液反应 | |
| D. | 该无色化合物受热容易分解 |
14.实验室中保存下列试剂的方法,不正确的是( )
| A. | 保存氢氧化钠溶液,常用带橡胶塞的玻璃瓶 | |
| B. | 保存浓硝酸,常用带玻璃塞的棕色试剂瓶 | |
| C. | 保存金属铝时,常在试剂瓶中加入煤油进行封存 | |
| D. | 保存氢氟酸时,常用塑料瓶而不用玻璃瓶 |
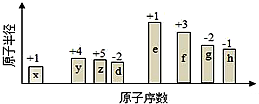 随原子序数的递增,八种短周期元素(用字母表示)原子半径的相对大小、最高正价或最低负价的变化如图所示.根据判断出的元素回答下列问题:
随原子序数的递增,八种短周期元素(用字母表示)原子半径的相对大小、最高正价或最低负价的变化如图所示.根据判断出的元素回答下列问题: ;B是常见的液态化合物,其稀溶液易被催化分解,可使用的催化剂为AB.(填序号)
;B是常见的液态化合物,其稀溶液易被催化分解,可使用的催化剂为AB.(填序号)