题目内容
18.能正确表示下列反应的离子方程式是( )| A. | 将氯气通入水中:Cl2+H2O═2H++Cl-+ClO- | |
| B. | Ca(HCO3)2溶液与少量的NaOH溶液混合2HCO3-+Ca2++2OH-═2 H2O+CaCO3↓+CO32- | |
| C. | 磁性氧化铁溶液与稀硝酸:3Fe3O4+28H++NO3-═9Fe3++NO↑+14H2O | |
| D. | NH4HCO3溶液与过量的NaOH溶液混合共热:NH4++OH-$\frac{\underline{\;\;△\;\;}}{\;}$NH3↑+H2O |
分析 A.次氯酸为弱电解质,保留化学式;
B.氢氧化钠少量反应生成碳酸钙、碳酸氢钠和水;
C.硝酸根离子具有强的氧化性能够氧化二价铁离子;
D.漏掉碳酸氢根离子与氢氧根离子的反应.
解答 解:A.将氯气通入水中,离子方程式:Cl2+H2O═H++Cl-+HClO,故A错误;
B.Ca(HCO3)2溶液与少量的NaOH溶液混合,离子方程式Ca2++HCO3-+OH-=CaCO3↓+H2O,故B错误;
C.磁性氧化铁溶液与稀硝酸,离子方程式:3Fe3O4+28H++NO3-═9Fe3++NO↑+14H2O,故C正确;
D.NH4HCO3溶液与过量的NaOH溶液混合共,离子方程式:NH4++HCO3-+2OH-═NH3↑+H2O+CO32-+H2O,故D错误;
故选:C.
点评 本题考查熟练掌握离子共存的条件、离子方程式的书写原则是解题关键,注意化学式的拆分、原子个数、电荷数守恒规律,题目难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
20.甘氨酸和丙氨酸以1:1的配比两两缩合后,得到的产物可能是( )


| A. | ①② | B. | ①②③ | C. | ①②③④ | D. | ①②③④⑤ |
3.阅读下表中短周期主族元素的相关信息.
请回答:
(1)写出E在元素周期表中的位置:第二周期第ⅣA族;C与D形成的化合物类型是共价化合物(离子化合物、共价化合物)
(2)写出A2B2晶体中存在的化学键:离子键、共价键.
(3)A在真空、高压下能与由D、E组成的分子呈正四面体结构的化合物Y反应生成2种固体物质,其中一种是自然界中硬度最大的物质,此反应在科学上有“稻草变黄金”的美称.写出Y的电子式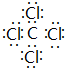 ,并写出该反应的化学方程式4Na+CCl4$\frac{\underline{\;真空高压\;}}{\;}$4NaCl+C.
,并写出该反应的化学方程式4Na+CCl4$\frac{\underline{\;真空高压\;}}{\;}$4NaCl+C.
(4)常温下,0.1mol•L-1 X溶液的pH>7(填“>”“=”或“<”).简述X可以做家用消毒剂的理由:ClO-+H2O?HClO+OH-.(用化学方程式表示)
(5)写出A2B2和EB2反应的化学方程式:2Na2O2+2CO2═2Na2CO3+O2. 指出氧化剂是Na2O2、还原剂是Na2O2.
| 元素代号 | 相关信息 |
| A | A的单质能与冷水剧烈反应,得到强碱性溶液 |
| B | B的原子最外层电子数是其内层电子数的三倍 |
| C | 在第3周期元素中,C的简单离子半径最小 |
| D | A、B、D组成的36电子的化合物X是常用消毒剂的主要成分 |
| E | 所有有机物中都含有E元素 |
(1)写出E在元素周期表中的位置:第二周期第ⅣA族;C与D形成的化合物类型是共价化合物(离子化合物、共价化合物)
(2)写出A2B2晶体中存在的化学键:离子键、共价键.
(3)A在真空、高压下能与由D、E组成的分子呈正四面体结构的化合物Y反应生成2种固体物质,其中一种是自然界中硬度最大的物质,此反应在科学上有“稻草变黄金”的美称.写出Y的电子式
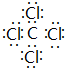 ,并写出该反应的化学方程式4Na+CCl4$\frac{\underline{\;真空高压\;}}{\;}$4NaCl+C.
,并写出该反应的化学方程式4Na+CCl4$\frac{\underline{\;真空高压\;}}{\;}$4NaCl+C.(4)常温下,0.1mol•L-1 X溶液的pH>7(填“>”“=”或“<”).简述X可以做家用消毒剂的理由:ClO-+H2O?HClO+OH-.(用化学方程式表示)
(5)写出A2B2和EB2反应的化学方程式:2Na2O2+2CO2═2Na2CO3+O2. 指出氧化剂是Na2O2、还原剂是Na2O2.
10.下列括号中的物质是除去杂质所需的药品,其中错误的是( )
| A. | NaCl溶液中有杂质Na2SO4(适量的BaCl2溶液) | |
| B. | FeSO4溶液中有杂质CuSO4 (Fe粉) | |
| C. | CO2气体中有少量CO(灼热的氧化铜) | |
| D. | SO2气体中有少量HCl气体(NaOH溶液) |
8.下表是A、B、C、D四种有机物的有关信息:
回答下列问题:
(1)A与溴的四氯化碳溶液反应的生成物的名称是1,2-二溴乙烷.
(2)A与氢气发生加成反应后生成物质E,与E在分子组成和结构上相似的有机物有一大类(俗称“同系物”),它们均符合通式CnH2n+2.当n=4时,这类有机物开始出现同分异构体.
(3)B具有的性质是②③(填序号).
①无色无味液体;②有毒;③不溶于水;④密度比水大;⑤与酸性KMnO4溶液和溴水反应褪色;⑥任何条件下不与氢气反应.写出在浓硫酸作用下,B与浓硝酸反应的化学方程式: +HO-NO2$→_{△}^{浓硫酸}$
+HO-NO2$→_{△}^{浓硫酸}$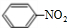 +H2O.
+H2O.
(4)C与D反应能生成相对分子质量为100的酯,该反应的反应类型为酯化反应(取代反应);其化学方程式为 .
.
| A | 1使溴的四氯化碳溶液褪色;②比例模型为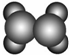 ;③能与水在一定条件下反应生成C ;③能与水在一定条件下反应生成C |
| B | 1C、H两种元素组成;②球棍模型为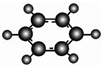 |
| C | ①由C、H、O三种元素组成;②能与Na反应,但不能与NaOH溶液反应;③能与D反应生成相对分子质量为100的酯 |
| D | ①由C、H、O三种元素组成;②球棍模型为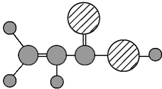 |
(1)A与溴的四氯化碳溶液反应的生成物的名称是1,2-二溴乙烷.
(2)A与氢气发生加成反应后生成物质E,与E在分子组成和结构上相似的有机物有一大类(俗称“同系物”),它们均符合通式CnH2n+2.当n=4时,这类有机物开始出现同分异构体.
(3)B具有的性质是②③(填序号).
①无色无味液体;②有毒;③不溶于水;④密度比水大;⑤与酸性KMnO4溶液和溴水反应褪色;⑥任何条件下不与氢气反应.写出在浓硫酸作用下,B与浓硝酸反应的化学方程式:
 +HO-NO2$→_{△}^{浓硫酸}$
+HO-NO2$→_{△}^{浓硫酸}$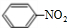 +H2O.
+H2O.(4)C与D反应能生成相对分子质量为100的酯,该反应的反应类型为酯化反应(取代反应);其化学方程式为

 实验室用如图装置制取少量溴苯,试填写下列空白.
实验室用如图装置制取少量溴苯,试填写下列空白.