题目内容
在A.CH3OH(l)+3/2O2(g)![]() CO2(g)+2H2O(l);ΔH=+725.8 kJ·mol-1
CO2(g)+2H2O(l);ΔH=+725.8 kJ·mol-1
B.2CH3OH(l)+3O2(g)![]() 2CO2(g)+4H2O(l);ΔH=-1452 kJ·mol-1
2CO2(g)+4H2O(l);ΔH=-1452 kJ·mol-1
C.2CH3OH(l) +3O2(g)![]() 2CO2(g)+4H2O(l);ΔH=-725.8 kJ·mol-1
2CO2(g)+4H2O(l);ΔH=-725.8 kJ·mol-1
D.2CH3OH(l) + 3O2(g)![]() 2CO2(g)+4H2O(l);ΔH=+1452 kJ·mol-1
2CO2(g)+4H2O(l);ΔH=+1452 kJ·mol-1
解析:在![]() ,2 mol CH3OH燃烧生成CO2和液态水时放出的热量为1452 kJ。
,2 mol CH3OH燃烧生成CO2和液态水时放出的热量为1452 kJ。
答案:B

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案 目标测试系列答案
目标测试系列答案
| c(X)/ mol·L-1 | c(Y)/ mol·L-1 | v/ mol·L-1·s-1 |
1 | 0.10 | 0.10 | 4.0×10-4 |
2 | 0.20 | 0.10 | 1.6×10-3 |
3 | 0.30 | 0.10 | 3.6×10-3 |
4 | 0.30 | 0.20 | 7.2×10-3 |
根据以上实验数据,完成下列问题:
(1)上述反应在
(2)当c(X)=c(Y)=0.25 mol·L-1时,v=_______________。
(10分)“低碳循环”已经引起了国民的重视,试回答下列问题:
(1)煤的气化和液化可以提高燃料的利用率。
已知25℃,101 时:
时:

则在25℃,101 时:
时: .
.
(2)高炉炼铁是CO气体的重要用途之一,其基本反应为: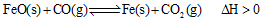 ,已知在1100℃时,该反应的化学平衡常数K=0.263。
,已知在1100℃时,该反应的化学平衡常数K=0.263。
①温度升高,化学平衡移动后达到新的 平衡,此时平衡常数K值 (填“增大”、“减小”或“不变”);
平衡,此时平衡常数K值 (填“增大”、“减小”或“不变”);
②1100℃时测得高炉时, ,在这种情况下,该反应是否处于化学平衡状态? (填“是”或“否”),其判断依据是 。
,在这种情况下,该反应是否处于化学平衡状态? (填“是”或“否”),其判断依据是 。
③目前工业上可用 来生产燃料甲醇
来生产燃料甲醇 ,有关反应为:
,有关反应为: 。现向体积为1L的密闭容器中,充入1mol
。现向体积为1L的密闭容器中,充入1mol 和3mol
和3mol ,反应过程中测得
,反应过程中测得 和
和 (g)的浓度随时间的变化如图所示。
(g)的浓度随时间的变化如图所示。
①从反应开始到平衡,氢气的平均反应速率 ;
;
②下列措施能使 增大的是
增大的是  (填符号)。
(填符号)。
| A.升高温度 |
B.再充入 |
C.再充入 |
D.将 (g)从体系中分离 (g)从体系中分离 |
 ,在这种情况下,该反应是否处于化学平衡状态? (填“是”或“否”),其判断依据是 。
,在这种情况下,该反应是否处于化学平衡状态? (填“是”或“否”),其判断依据是 。 ;
; 时:
时:

 .
. ,已知在1100℃时,该反应的化学平衡常数K=0.263。
,已知在1100℃时,该反应的化学平衡常数K=0.263。 ,在这种情况下,该反应是否处于化学平衡状态? (填“是”或“否”),其判断依据是
。
,在这种情况下,该反应是否处于化学平衡状态? (填“是”或“否”),其判断依据是
。 来生产燃料甲醇,有关反应为:
来生产燃料甲醇,有关反应为: 。现向体积为1L的密闭容器中,充入1mol
。现向体积为1L的密闭容器中,充入1mol ,反应过程中测得
,反应过程中测得 (g)的浓度随时间的变化如图所示。
(g)的浓度随时间的变化如图所示。
 ;[来源:]
;[来源:] 增大的是 (填符号)。
增大的是 (填符号)。 (g)从体系中分离
E.充入He(g),使体系压强增大
(g)从体系中分离
E.充入He(g),使体系压强增大