题目内容
14.将0.1mol•L-1的KI溶液和0.05mol•L-1 Fe2(SO4)3溶液等体积混合后,取混合液分别完成下列实验,能说明溶液中存在化学平衡“2Fe3++2I-?2Fe2++I2”的是( )| 实验编号 | 实验操作 | 实验现象 |
| ① | 滴入KSCN溶液 | 溶液变红色 |
| ② | 滴入AgNO3溶液 | 有黄色沉淀生成 |
| ③ | 滴入K3[Fe(CN)6]溶液 | 有蓝色沉淀生成 |
| ④ | 滴入淀粉溶液 | 溶液变蓝色 |
| A. | ①和② | B. | ②和④ | C. | ③和④ | D. | ①和③ |
分析 只有可逆反应才能建立化学平衡,故要想证明化学平衡“2Fe3++2I-?2Fe2++I2”的存在,即需证明此反应为可逆反应,不能进行彻底.将0.1mol•L-1的KI溶液和②②等体积混合后,若此反应不可逆,则Fe3+和I-能恰好完全反应,则溶液中无Fe3+和I-,故只需要证明溶液中含Fe3+和I-,则即能证明此反应为可逆反应,能建立化学平衡.据此分析.
解答 解:将0.1mol•L-1的KI溶液和0.05mol•L-1 Fe2(SO4)3溶液等体积混合后,若此反应不可逆,则Fe3+和I-能恰好完全反应,则溶液中无Fe3+和I-,故只需要证明溶液中含Fe3+和I-,则即能证明此反应为可逆反应,能建立化学平衡.
①向溶液中滴入KSCN溶液,溶液变红,则说明溶液中有Fe3+,即能说明反应存在平衡,故①正确;
②向溶液中滴入AgNO3溶液有黄色沉淀生成,说明溶液中含I-,能说明反应存在平衡,故②正确;
③无论反应存不存在平衡,溶液中均存在Fe2+,滴入K3[Fe(CN)6]溶液均有蓝色沉淀生成,故③错误;
④无论反应存不存在平衡,溶液中均有I2,滴入淀粉溶液后溶液均变蓝色,故不能证明存在平衡,故④错误.
故选A.
点评 本题考查了反应的可逆性,应注意的是平衡只能建立在可逆反应上,故若证明平衡的存在,只需证明反应为可逆反应.

练习册系列答案
 阳光课堂课时优化作业系列答案
阳光课堂课时优化作业系列答案
相关题目
4.下列物质中既属于芳香化合物又属于醇的是( )
| A. |  | B. |  | C. |  | D. | CH3CH2OH |
5.下列离子方程式书写正确的是( )
| A. | 铁与氯化铁溶液反应:Fe+Fe3+═2Fe2+ | |
| B. | 氯化铝溶液与足量的氢氧化钠溶液反应:Al3++3OH-═Al(OH)3↓ | |
| C. | 氯气与氢氧化钠溶液反应:Cl2+2OH-═Cl-+ClO-+H2O | |
| D. | 碳酸氢钠溶液与稀盐酸反应:2H++CO32-═CO2↑+H2O |
2.关于相同物质的量浓度的NaHCO3溶液和Na2CO3溶液,下列说法不正确的是( )
| A. | 溶液中所含离子的种类相同 | B. | 溶液的pH相同 | ||
| C. | 都能与盐酸反应放出CO2气体 | D. | 都能使澄清石灰水变浑浊 |
6.下列关于自然界中碳循环(如图)的说法中,不正确的是( )

| A. | 呼吸作用涉及氧化还原反应 | B. | 碳循环具有全球性 | ||
| C. | 含碳化合物可相互转化 | D. | 碳元素均被氧化 |
4.依据元素周期表及元素周期律,下列推断正确的是( )
| A. | 碱性:Ca(OH)2>Mg(OH)2 | B. | 酸性:H3BO3>H2CO3 | ||
| C. | 热稳定性:NH3<PH3 | D. | 还原性:S2-<F- |
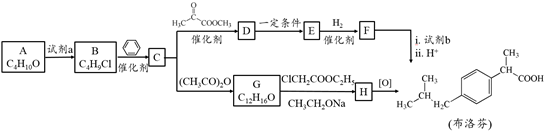

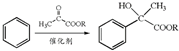
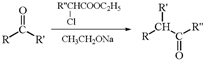
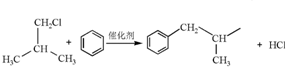 .
.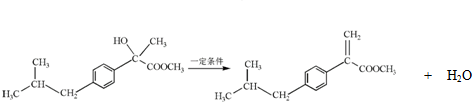 .
. ,H的含氧官能团的名称是醛基.
,H的含氧官能团的名称是醛基.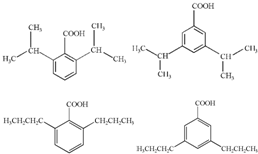 (其中两种).
(其中两种).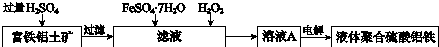
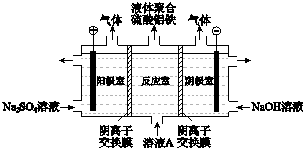 子交换膜只允许阴离子通过,电极为惰性电极)
子交换膜只允许阴离子通过,电极为惰性电极)