题目内容
【题目】某强酸性溶液 X,可能含有 Al3+、Ba2+、NH4+、Fe2+、Fe3+、CO32-、SO42-、SiO32-、NO3-中的一种或几种离子,取该溶液进行实验,其现象及转化如下图。反应过程中有一种气体是红棕色。请回答下列问题:
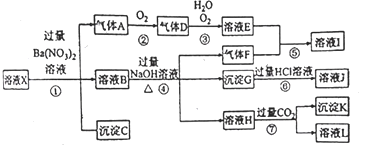
(1)由强酸性条件即可判断溶液X中一定不存在的离子有___________________。
(2)溶液X中,关于NO3-的判断一定正确的是___________。
a.一定有 b.一定没有 c.可能有
(3)产生气体A的离子方程式为________________ ,并用双线桥法表示电子转移的方向和数目。
(4)若转化③中,D、H2O、O2三种物质恰好发生化合反应生成E,则反应中D与O2的物质的量之比为__________。
(5)对不能确定是否存在的离子,可以另取X溶液,加入下列溶液中的—种,根据现象即可判断,该试剂最好是_____________ 。
①NaOH溶液 ②KSCN溶液 ③石蕊试剂 ④pH试纸 ⑤KMnO4溶液⑥氯水和KSCN的混合溶液
【答案】CO32-、SiO32- b  4∶1 ②
4∶1 ②
【解析】
某强酸性溶液X,则溶液中不存在弱酸根离子CO32-、SiO32-,溶液和硝酸钡溶液反应生成沉淀C,则溶液中存在SO42-,不存在和硫酸根离子反应的Ba2+,沉淀C是BaSO4;酸性条件下硝酸根离子具有强氧化性,所以溶液中Fe2+和NO3-不能共存,加入硝酸钡产生气体,则溶液中存在Fe2+,不存在NO3-,因此A是NO;A是NO,则D是NO2,二氧化氮化和水反应生成硝酸和NO,则E是HNO3;溶液B中加入氢氧化钠溶液时,产生气体F,则溶液中含有NH4+,F是NH3,硝酸和氨气反应生成硝酸铵,则I是NH4NO3;溶液中存在Fe3+,产生沉淀G,则沉淀G是Fe(OH)3,氢氧化铁和盐酸反应生成FeCl3,则J是FeCl3,溶液H中通入过量二氧化碳生成沉淀,则溶液中存在Al3+,沉淀K是Al(OH)3,溶液L是NaHCO3。据此分析解答。
(1)由强酸性条件即可判断溶液X中一定不存在弱酸根离子,所以不存在的离子有CO32-、SiO32-,故答案为:CO32-、SiO32-;
(2)根据上述分析,强酸性溶液中硝酸根离子具有强氧化性,如果存在硝酸根离子,则不存在亚铁离子,加入硝酸钡溶液时不能产生气体,所以溶液X中一定没有NO3-,故选b;故答案为:b;
(3)亚铁离子和硝酸反应生成铁离子、一氧化氮和水,反应的离子方程式为:3Fe2++NO3-+4H+=3Fe3++NO↑+2H2O,用双线桥法表示电子转移的方向和数目为: ,故答案为:
,故答案为: ;
;
(4)若转化③中,NO2、H2O、O2三种物质恰好发生化合反应生成HNO3,该反应方程式为:4NO2+2H2O+O2=4HNO3,则反应中D与O2的物质的量之比为4∶1,故答案为:4∶1。
(5)因为存在的亚铁离子被硝酸氧化生成了铁离子,因此溶液中Fe3+是否存在不能确定,Fe3+和硫氰化钾溶液反应生成血红色溶液,所以可以用硫氰化钾溶液检验,氢氧化钠尽管也能与铁离子反应生成红褐色的氢氧化铁沉淀,但存在Al3+、Fe2+,会干扰铁离子的检验,故最好选②,故答案为:②。