题目内容
下列说法正确的是
| A.Si是一种非金属主族元素,其晶体可用于制作计算机芯片 |
| B.工业上由NH3制碳铵属于氮的固定中的人工固氮 |
| C.Cl、Br、I的非金属性逐渐减弱,HCl、HBr、HI水溶液的酸性逐渐减弱 |
| D.S、P、Cl得电子能力和它们相应的最高价氧化物对应水化物的酸性均依次增强 |
A
解析试题分析:A.Si晶体可用于制作计算机芯片,正确;B.氮的固定是指由游离态的氮生成氮的化合物的过程,错误;C.Cl、Br、I的非金属性逐渐减弱,HCl、HBr、HI水溶液的酸性逐渐是增强的,与元素非金属性强弱对应的是最高价氧化物对应水化物的酸性,错误;D.正确的表述是P、S、Cl得电子能力和它们相应的最高价氧化物对应水化物的酸性均依次增强,错误;
考点:考查元素周期律相关知识。

 名师金手指领衔课时系列答案
名师金手指领衔课时系列答案X、Y、Z、W、M五种元素的原子序数依次增大,且X、Y、Z、W均为短周期中的非金属元素,X元素的原子形成的阴离子核外排布与氦原子相同,Z、W在周期表中处于相邻位置,它们的单质在常温下均为无色气体,Y原子的最外层电子数是内层电子数的2倍,M是地壳中含量最高的金属元素。下列说法正确的是( )
| A.五种元素的原子半径从大到小的顺序是:M> W> Z>Y>X |
| B.化合物X2W2、YW2、ZW2都含有极性共价键和非极性共价键 |
| C.工业上通常用电解熔融的MCl3来冶炼金属M |
| D.Z、X两元素能形成原子个数比为1∶3和2∶4的化合物 |
自然界中氧元素有三种同位素16O、17O、18O,氧元素的相对原子质量为15.9994,
由此可知16O的相对原子质量为( )
| A.>16 | B.<16 | C.=16 | D.不能确定 |
下列变化中,可逆性最不明显的是
| A.NH3+H2O→NH3·H2O | B.Br2+H2→2HBr |
| C.H2+I2→2HI | D.HClO→H++ClO- |
短周期元素X、Y、Z的原子序数依次递增,其原予的最外层电子数之和为13,X与Y、Z位于相邻周期,Z原子最外层电子数是X原子内层电子数的3倍或者是Y原子最外层电子数的3倍,下列说法正确的是( )
| A.X的氢化物溶于水生成弱酸 |
| B.Y与X可生成Y3X2型化合物 |
| C.Z的氢化物的水溶液在空气中存放不易变质 |
| D.Z的单质在氧气中燃烧可以生成两种酸性氧化物 |
PASS是新一代高效净水剂,它由X、Y、Z、W、R五种短周期元素组成,五种元素原子序数依次增大。X原子是所有原子中半径最小的,Y、R同主族,Z、W、R同周期,Y原子的最外层电子数是次外层的3倍,Z是常见的金属,能层数等于主族序数,W单质是人类将太阳能转变为电能的常用材料。下列说法正确的是( )
| A.Z与Y形成的化合物可作为耐高温材料 |
| B.WY2能与碱反应,但不能与任何酸反应 |
| C.原子半径按X、Y、Z、R、W的顺序依次增大 |
| D.熔沸点:X2R>X2Y |
短周期金属元素甲~戊在元素周期表中的相对位置如右表所示,下面判断正确的是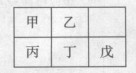
| A.原子半径:丙<丁<戊 |
| B.元素金属性:甲>丙 |
| C.氢氧化物碱性:丙<丁<戊 |
| D.丙的最高价氧化物水化物与戊的最高价氧化物水化物能发生反应 |
根据中学化学教材所附元素周期表判断,下列叙述不正确的是( )
| A.K层电子为奇数的所有元素所在族的序数与该元素原子的K层电子数相等 |
| B.L层电子为奇数的所有元素所在族的序数与该元素原子的L层电子数相等 |
| C.L层电子为偶数的所有主族元素所在族的序数与该元素原子的L层电子数相等 |
| D.M层电子为奇数的所有主族元素所在族的序数与该元素原子的M层电子数相等 |
X、Y、Z、W为四种短周期主族元素,其中X、Z同族,Y、Z同周期,W是短周期主族元素中原子半径最大的,X原子最外层电子数是核外电子层数的3倍,Y的最高正价与最低负价代数和为6。下列说法正确的是
| A.Y元素最高价氧化物对应的水化物化学式H2YO4 |
| B.原子半径由大到小的顺序为:Z>Y> W |
| C.X、Z两种元素的气态氢化物中,Z的气态氢化物较稳定 |
| D.X与W形成的两种化合物中,阴、阳离子物质的量之比均为1︰2 |