题目内容
下列变化中,可逆性最不明显的是
| A.NH3+H2O→NH3·H2O | B.Br2+H2→2HBr |
| C.H2+I2→2HI | D.HClO→H++ClO- |
B
解析试题分析:Br2+H2→2HBr为不可逆反应。HClO是弱电解质,存在电离平衡。
考点:考查化学反应可逆性有关问题。

练习册系列答案
 提分百分百检测卷单元期末测试卷系列答案
提分百分百检测卷单元期末测试卷系列答案 小学期末标准试卷系列答案
小学期末标准试卷系列答案
相关题目
如图是元素周期表短周期的一部分,已知B原子与C原子核外电子总数和为A原子核外电子总数的4倍,则以下推断正确的是( )
| | A | |
| B | | C |
A.三者皆为非金属元素
B.B与A、B与C均可以形成离子化合物
C.三者核电荷数之和为40
D.B与C只能形成一种共价化合物
下列说法正确的是
| A.元素铯的两种核素137Cs比133Cs多四个质子 |
| B.等质量的H2、D2、T2三种气体的电子数之比为2∶3∶6 |
| C.一种元素只能有一种质量数 |
| D.在氮原子中,质子数为7而中子数不一定为7 |
元素的性质呈周期性变化的根本原因是 ( )
| A.元素原子量的递增,量变引起质变 |
| B.元素的原子半径呈周期性变化 |
| C.元素的金属性和非金属性呈周期性变化 |
| D.元素原子的核外电子排布呈周期变化 |
下列说法正确的是
| A.Si是一种非金属主族元素,其晶体可用于制作计算机芯片 |
| B.工业上由NH3制碳铵属于氮的固定中的人工固氮 |
| C.Cl、Br、I的非金属性逐渐减弱,HCl、HBr、HI水溶液的酸性逐渐减弱 |
| D.S、P、Cl得电子能力和它们相应的最高价氧化物对应水化物的酸性均依次增强 |
已知X、Y是主族元素,I为电离能,单位是kJ·mol-1。请根据下表所列数据判断,错误的是
| 元素 | I1 | I2 | I3 | I4 |
| X | 500 | 4600 | 6900 | 9500 |
| Y | 580 | 1800 | 2700 | 11600 |
A.元素X与氯形成化合物时,化学式可能是XCl
B.元素Y是ⅢA族元素
C.若元素X、Y处于第三周期,X最高价氧化物对应水化物的碱性强于Y最高价氧化物对应水化物的碱性
D.若元素Y处于第三周期,它可与冷水剧烈反应
下列关于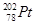 的说法正确的是
的说法正确的是
A.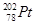 和 和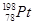 的质子数相同,互称为同位素 的质子数相同,互称为同位素 |
B.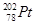 和 和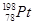 的中子数相同,互称为同位素 的中子数相同,互称为同位素 |
C.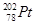 和 和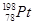 的核外电子数相同,是同一种核素 的核外电子数相同,是同一种核素 |
D.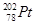 和 和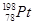 的质量数不同,不能互称为同位素 的质量数不同,不能互称为同位素 |
