题目内容
18.某铝土矿主要含Al2O3和SiO2.某课题组以此为原料回收氧化铝,设计实验流程如下: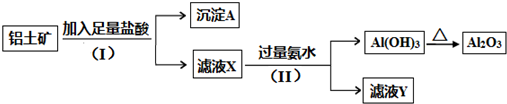
(1)步骤(I)中分离溶液和沉淀的操作名称是过滤.
(2)沉淀A中一定含有SiO2(用化学式表示),该物质属于酸性(填“酸性”或“碱性”)氧化物.
(3)写出步骤(Ⅱ)中生成Al(OH)3的离子方程式Al3++3NH3•H2O═Al(OH)3↓+3NH4+.
(4)实验室里用Na[Al(OH)4]溶液制取Al(OH)3最好选用C(填序号).
A.NaOH溶液 B.稀硫酸 C.二氧化碳
(5)取5.4g铝土矿进行实验,最后得到氧化铝5.1g,则该铝土矿中铝的含量为50%(假设实验过程没有损失).
分析 某铝土矿主要含Al2O3和SiO2,由流程可知,加足量盐酸过滤得到沉淀A为SiO2,溶液X中含Al3+,加过量氨水溶液过滤得到沉淀Al(OH)3,氢氧化铝加热分解生成氧化铝和水,滤液Y为氯化铵溶液,
(1)分离溶液和沉淀的操作是过滤;
(2)分析可知沉淀A为二氧化硅,二氧化硅溶于碱反应生成盐和水属于酸性氧化物;
(3)步骤(Ⅱ)中生成Al(OH)3的反应是氯化铝溶液中铝离子和氨水反应生成氢氧化铝沉淀和氯化铵;
(4)氢氧化铝是两性氢氧化物,用Na[Al(OH)4]溶液制取Al(OH)3最好是通入二氧化碳制备;
(5)依据元素守恒计算铝元素质量,得到铝元素的含量.
解答 解:某铝土矿主要含Al2O3和SiO2,由流程可知,加足量盐酸过滤得到沉淀A为SiO2,溶液X中含Al3+,加过量氨水溶液过滤得到沉淀Al(OH)3,氢氧化铝加热分解生成氧化铝和水,滤液Y为氯化铵溶液,
(1)步骤(I)中分离溶液和沉淀的操作名称是过滤,故答案为:过滤;
(2)分析可知沉淀A中一定含二氧化硅,二氧化硅溶于碱反应生成盐和水属于酸性氧化物,故答案为:SiO2;酸性;
(3)步骤(Ⅱ)中生成Al(OH)3的反应是氯化铝溶液中铝离子和氨水反应生成氢氧化铝沉淀和氯化铵,反应的离子方程式为:Al3++3NH3•H2O═Al(OH)3↓+3NH4+,
故答案为:Al3++3NH3•H2O═Al(OH)3↓+3NH4+;
(4)氢氧化铝是两性氢氧化物,易溶于氢氧化钠和硫酸溶液,用Na[Al(OH)4]溶液制取Al(OH)3最好是通入二氧化碳制备,四羟基合铝酸钠溶液与二氧化碳反应,生成氢氧化铝和碳酸氢钠,反应方程式为Na〔Al(OH)4〕+CO2═Al(OH)3↓+NaHCO3,离子反应为:CO2+[Al(OH)4]-=Al(OH)3↓+HCO3-,故选C,
故答案为:C;
(5)取5.4g铝土矿进行实验,最后得到氧化铝5.1g,实验过程没有损失,则依据铝元素守恒计算,则该铝土矿中铝的含量=$\frac{\frac{5.1g}{102g/mol}×2×27g/mol}{5.4g}$×100%=50%,
故答案为:50%;
点评 本题考查物质的分离、提纯的方法及基本操作的综合应用,为高频考点,把握流程中物质的性质、发生的反应、混合物分离方法为解答的关键,侧重分析、推断及实验能力的综合考查,题目难度中等.

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案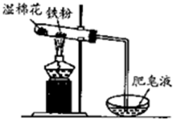
| A. | 试管中的铁粉用绕成团的细铁丝代替 | |
| B. | 将试管底部的湿棉花移到试管口部 | |
| C. | 将铁粉附着在石棉绒上,以增大与水蒸气的接触面积 | |
| D. | 点燃肥皂泡验证氢气的生成 |
| A. | 0.5 mol/L | B. | 0.25 mol/L | C. | 5 mol/L | D. | 1 mol/L |
| A. | c(H+)=1×10-7mol/L的溶液 | |
| B. | 非电解质溶于水得到的溶液 | |
| C. | 酸与碱恰好完全反应生成正盐的溶液 | |
| D. | c 2(H+)=Kw |
| A. | 过滤 | B. | 蒸发 | C. | 蒸馏 | D. | 分液 |
| A. | 将光能转变为化学能 | B. | 将化学能转变为光能 | ||
| C. | 将热能转变为电能 | D. | 将化学能转变为电能 |
| A. | 熟石灰可用来做建筑材料以及中和酸性土壤 | |
| B. | 用水灭火的原理是降低了可燃物的着火点 | |
| C. | 用C、H2、CO都可以将CuO还原成Cu | |
| D. | 燃烧和缓慢氧化都是放热反应 |
| A. | 工业用Cl2与澄清石灰水反应制取漂白粉 | |
| B. | 天然纤维与合成纤维的主要成分都是纤维素 | |
| C. | 福尔马林可用于保存海鲜制品 | |
| D. | Na可用于冶炼金属钛 |
 氯酸钠(NaClO3)是无机盐工业的重要产品之一.
氯酸钠(NaClO3)是无机盐工业的重要产品之一.