题目内容
【题目】二氧化碳是用途非常广泛的化工基础原料,回答下列问题:
(1)工业上可以用CO2来生产燃料甲醇。
已知:CO2(g) +3H2(g) CH3OH(l) +H2O(l) H= -130kJmol-1
2H2(g)+O2(g)=2H2O(l) H=-572kJmol-1
CH3OH(1)的燃烧热H=________kJmol-1。
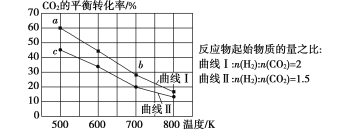
(2)在催化剂作用下,CO2和CH4可直接转化为乙酸:CO2(g)+CH4(g)=CH3COOH(g) H>0,在不同温度下乙酸的生成速率变化如图所示。
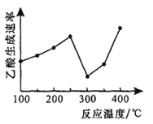
①当温度在250°C-300°C范围时,乙酸的生成速率减慢的主要原因是___________。
②欲使乙酸的平衡产率提高,应采取的措施是__________(任写一条措施即可)。
(3)一定条件下,在密闭容器中发生反应,2CO(g) C(s)+CO2(g).
①下列能说明该反应达到平衡的是______________。
A 容器内混合物的质量不变
B CO和CO2的物质的量之比不再变化
C 混合气体的平均摩尔质量不再变化
D 生成amo1CO2的同时消耗2amol.CO
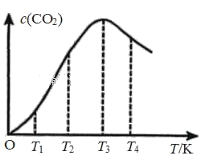
②向某恒容容器中通入一定量的CO发生上述反应,在不同温度下CO2的物质的量浓度c (CO2)随温度的变化如上图所示,则该反应为________(填“放热”或“吸热”)反应。
③向容积可变的某恒压容器中通入amolCO,T°C时反应经过10min达平衡,CO的体积分数为75%。CO的平衡转化率为________。在容积改变的条件下,反应速率可用单位时间内反应物成生成物的物质的量变化来表示,则0-10min内平均反应速率v(CO2)=________。
【答案】728 催化剂活性降低(或催化剂中毒等) 升高温度或增大压强等 BC 放热 40% 0.02a molmin1
【解析】
(1)根据已知方程式构建目标方程式,根据盖斯定律计算CH3OH的燃烧热;
(2)①温度超过250℃时,催化剂的催化效率降低,所以温度升高而乙酸的生成速率降低;
②欲使乙酸的平衡产率提高,应该使平衡正向移动;
(3)①根据化学平衡状态的特征解答,当反应达到平衡状态时,正逆反应速率相等,各物质的浓度、百分含量不变,以及由此衍生的一些量也不发生变化,解题时要注意,选择判断的物理量,随着反应的进行发生变化,当该物理量由变化到定值时,说明可逆反应到达平衡状态;
②向某恒容容器中通入一定量的CO发生上述反应2CO(g)C(s)+CO2(g),温度越高,反应速率越快,达到平衡的时间越短,随着温度的升高生成CO2量逐渐增多,但温度高于T3后,随着温度升高,c(CO2)又逐渐减小,则平衡逆向移动;
③根据三段式进行计算CO的平衡转化率;根据反应速率可用单位时间内反应物或生成物的物质的量变化来表示信息进行计算010min内平均反应速率。
(1)已知:① CO2(g) +3H2(g) CH3OH(l) +H2O(l) H= -130kJmol-1;
② 2H2(g)+O2(g)=2H2O(l) H=-572kJmol-1;根据盖斯定律,将②×![]() ①得:CH3OH(l)+
①得:CH3OH(l)+![]() O2(g)=2H2O(l)+CO2(g) ,则△H=(572kJ/mol×
O2(g)=2H2O(l)+CO2(g) ,则△H=(572kJ/mol×![]() )(130kJ/mol)=728kJ/mol,故CH3OH的燃烧热 △H=728kJ/mol;
)(130kJ/mol)=728kJ/mol,故CH3OH的燃烧热 △H=728kJ/mol;
故答案为:728;
(2)①催化剂的活性与温度有关,当温度在250℃300℃范围时,乙酸的生成速率减慢的主要原因是催化剂活性较低(或催化剂中毒等);
故答案为:催化剂活性降低(或催化剂中毒等);
②欲使乙酸的平衡产率提高,应该使平衡正向移动,因为正反应为吸热反应,升高温度,平衡正向移动,乙酸的平衡产率提高;增大压强,平衡正向移动,乙酸的平衡产率提高;
故答案为:升高温度或增大压强等;
(3)①该反应2CO(g)C(s)+CO2(g)为反应前后气体体积变化的反应,
A. 反应前后混合物的质量始终不变,则容器内混合物的质量不变,不能作为判断平衡的依据,故A错误;
B. 随着反应的进行,CO的物质的量逐渐减小,CO2的物质的量逐渐增大,则CO和CO2的物质的量之比逐渐减小,则当CO和CO2的物质的量之比不再变化时,说明CO和CO2的量不再改变,即各物质的浓度、百分含量不变,能判断达到平衡状态,故B正确;
C. 混合气体为一氧化碳与二氧化碳的混合气体,则平衡正向进行时,混合气体的平均摩尔质量越接近于二氧化碳的摩尔质量,平均摩尔质量为变化的量,当混合气体的平均摩尔质量不再变化时,能判断达到平衡状态,故C正确;
D. 生成a molCO2的同时消耗2a mol.CO,二者均表示正反应速率,不能说明正逆反应速率相等,则不能作为判断平衡的依据,故D错误;
故答案为:BC;
②向某恒容容器中通入一定量的CO发生上述反应2CO(g)C(s)+CO2(g),温度越高,反应速率越快,达到平衡的时间越短,随着温度的升高生成CO2量逐渐增多,但温度高于T3后,随着温度升高,c(CO2)又逐渐减小,则平衡逆向移动,说明正反应方向为放热反应;
故答案为;放热;
③向容积可变的某恒压容器中通入amolCO,T°C时反应经过10min达平衡,CO的体积分数为75%.CO的平衡转化率为,可列三段式:
2CO(g)C(s)+CO2
开始(mol):a 0 0
变化(mol):2x x x
平衡(mol):a-2x x x
达平衡时,CO的体积分数为75%,所以![]() ,解得x=0.2a,则CO的平衡转化率=
,解得x=0.2a,则CO的平衡转化率=![]() ;
;
在容积改变的条件下,反应速率可用单位时间内反应物或生成物的物质的量变化来表示,则010min内平均反应速率![]() ;
;
故答案为:40%;0.02a molmin1。

【题目】对氮、碳及其化合物的研究具有重要意义。
(1)用肼![]() 为燃料,四氧化二氮做氧化剂,两者反应生成氮气和气态水。已知:
为燃料,四氧化二氮做氧化剂,两者反应生成氮气和气态水。已知:![]()
![]() ,
, ![]() ;
;![]()
![]() ,
, ![]() ;则
;则![]()
![]() ______ (用
______ (用![]() 、
、![]() 表示),该反应的化学平衡常数
表示),该反应的化学平衡常数![]() ______ (用
______ (用![]() 、
、![]() 表示)。
表示)。
(2)汽车尾气转化反应:![]() 未配平
未配平![]() ,将NO和CO转化为和
,将NO和CO转化为和![]() 和
和![]() ,实现除污,每生成
,实现除污,每生成![]() 还原剂失去电子数为 ______ 。
还原剂失去电子数为 ______ 。
(3)大气污染物氮氧化物可以用活性炭还原法处理。某研究小组向某2L的密闭容器中加入一定量的活性炭和NO,发生反应![]() 。在
。在![]() 时,反应进行到不同时间测得各物质的物质的量如下:
时,反应进行到不同时间测得各物质的物质的量如下:
0 | 10 | 20 | 30 | 40 | 50 | |
NO |
|
|
|
|
|
|
| 0 |
|
|
|
|
|
| 0 |
|
|
|
|
|
①0~10min内,NO的平均反应速率![]() ______ ;
______ ;![]() 时,该反应的平衡常数
时,该反应的平衡常数![]() ______ 。
______ 。
②30min后,只改变某一条件,反应重新达到平衡,根据上表中的数据判断改变的条件可能是 ______ ![]() 填字母编号
填字母编号![]() 。
。
a.加入一定量的活性炭 b.通入一定量的NO
c.恒容时,充入一定量的氦气 d.加入合适的催化剂
(4)氨燃料电池使用的电解质溶液是![]() 的KOH溶液,电池反应为:
的KOH溶液,电池反应为:![]() 。放电时,该电池正极的电极反应式为 ______。
。放电时,该电池正极的电极反应式为 ______。
(5)实验室中用NaOH溶液吸收![]() ,发生反应为
,发生反应为![]() 。所得混合液中所有离子浓度由大到小的顺序为 _________ 。
。所得混合液中所有离子浓度由大到小的顺序为 _________ 。
【题目】乙酸异戊酯是组成蜜蜂信息素的成分之一,具有香蕉的香味。实验室制备乙酸异戊酯的反应:
![]() +
+![]()
![]()
![]() +H2O
+H2O
装置示意图为:

有关数据如下:
相对分子质量 | 密度/(gcm-3) | 沸点/℃ | 水中溶解性 | |
异戊醇 | 88 | 0.8123 | 131 | 微溶 |
乙酸 | 60 | 1.0492 | 118 | 溶 |
乙酸异戊酯 | 130 | 0.8670 | 142 | 难溶 |
实验步骤:
在A中加入![]() 异戊醇
异戊醇![]() 、数滴浓硫酸和
、数滴浓硫酸和![]() 片碎瓷片。开始缓慢加热A,回流50min。反应液冷至室温后倒入分液漏斗中,分别用少量水、饱和碳酸氢钠溶液和水洗涤;分出的产物加入少量无水
片碎瓷片。开始缓慢加热A,回流50min。反应液冷至室温后倒入分液漏斗中,分别用少量水、饱和碳酸氢钠溶液和水洗涤;分出的产物加入少量无水![]() 固体,静置片刻,过滤除去
固体,静置片刻,过滤除去![]() 固体,进行蒸馏纯化,收集
固体,进行蒸馏纯化,收集![]() 馏分,得乙酸异戊脂
馏分,得乙酸异戊脂![]()
回答下列问题:
(1)仪器B的名称是_________
(2)在洗涤操作中,第一次水洗的主要目的是_____。第二次水洗的主要目的是_____
(3)在洗涤、分液操作中,应充分振荡,然后静置,待分层后(填标号)_______
a、直接将乙酸异戊脂从分液漏斗的上口倒出
b、直接将乙酸异戊从分液端斗的下口放出
c、先将水层从分液漏斗的下口放出,再将乙酸异戊脂从下口放出
d、先将水层从分液漏斗的下口放出,再将乙酸异戊酚从上口倒出
(4)本实验中加入过量乙酸的目的是_____________
(5)实验中加入少量无水![]() 的目的是____________
的目的是____________
(6)在蒸馏操作中,仪器选择及安装都正确的是_________![]() 填标号
填标号![]() 。
。
a.  b.
b.  c.
c.  d.
d. 
(7)本实验的产率是________![]() 填标号
填标号![]()
![]() .
.![]() .
.![]()
(8)在进行蒸馏操作时:若从![]() 便开始收集馏分,会使实验的产率偏_________
便开始收集馏分,会使实验的产率偏_________![]() 填“高”或“低”
填“高”或“低”![]() ,其原因是___________
,其原因是___________
【题目】![]() ,向5L恒容密闭容器中充入
,向5L恒容密闭容器中充入![]() 气体,发生反应
气体,发生反应![]() ,一段时间后达到平衡,测得此过程中从外界共吸收了
,一段时间后达到平衡,测得此过程中从外界共吸收了![]() 的热量.当温度度不变时,改变某一条件,下列结论正确的是
的热量.当温度度不变时,改变某一条件,下列结论正确的是![]()
条件改变 | 结论 | |
A | 平衡后向容器中充入1molHe | 平衡常数不变,混合气体的密度也不变 |
B | 起始时向容器中充入 | 反应达到平衡前 |
C | 起始时向容器中充入 | 达到平衡时共放出 |
D | 起始时向容器中充入 | 达到平衡时, |
A.AB.BC.CD.D