题目内容
【题目】铁的某种氧化物20 g,在加热的条件下通入足量的CO完全反应,将生成的气体用石灰水吸收,得到沉淀37.5 g,求该氧化物中铁元素与氧元素的质量比。_________
【答案】该氧化物中铁元素与氧元素的质量比为7∶3
【解析】
根据元素守恒的原理分析解答,即CO![]() 2
2![]() 3。
3。
CO与铁的氧化物反应生成单质铁和CO2气体。CO2通入石灰水中,与氢氧化钙反应生成CaCO3沉淀37.5 g。由此可计算出CO2的质量。设生成37.5 g CaCO3沉淀时,需CO2的质量为x,则

![]()
解得x=16.5 g
二氧化碳的物质的量是16.5÷44g/mol=0.375mol,因此氧化物中氧元素的质量是0.375mol×16g/mol=6g,则铁元素的质量是20g-6g=14g,因此该氧化物中铁元素与氧元素的质量比为m(Fe)∶m(O)=14∶6=7∶3。

练习册系列答案
 数学奥赛暑假天天练南京大学出版社系列答案
数学奥赛暑假天天练南京大学出版社系列答案
相关题目
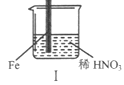
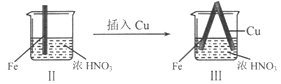
【题目】在通风橱中进行下列实验:
步骤 |
|
| |
现象 | Fe表面产生大量无色气泡,液面上方变为红棕色 | Fe表面产生少量红棕色气泡后,迅速停止 | Fe、Cu接触后,其表面均产生红棕色气泡 |
下列说法不正确的是
A. I中气体由无色变红棕色的化学方程式:2NO+O2=2NO2
B. II中的现象说明Fe表面形成致密的氧化层,阻止Fe进一步反应
C. 对比I、II中现象,说明稀HNO3的氧化性强于浓HNO3
D. 针对Ⅲ中现象,在Fe、Cu之间连接电流计,可判断Fe是否被氧化