题目内容
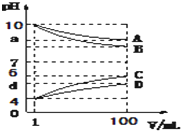 A、B、C、D是由下面的一种阳离子和一种阴离子组成的化合物(阳离子:NH4+、Na+、H+,阴离子:Cl-、CH3COO -、OH-),在水溶液中A、D能促进水的电离,B、C能抑制水的电离.常温下各物质从1mL稀释到100mL,pH的变化如图Ⅰ所示,请回答:
A、B、C、D是由下面的一种阳离子和一种阴离子组成的化合物(阳离子:NH4+、Na+、H+,阴离子:Cl-、CH3COO -、OH-),在水溶液中A、D能促进水的电离,B、C能抑制水的电离.常温下各物质从1mL稀释到100mL,pH的变化如图Ⅰ所示,请回答:(1)pH=10的A、B溶液中由水电离出的c(OH-)之比为
(2)物质的量浓度为c1的X溶液与pH=3的C溶液等体积混合后得到单一的D溶液,则该X溶液中c(OH-)
(3)等浓度的A与C溶液等体积混合,二者发生反应的离子方程式为:
(4)若D与B稀溶液混合后呈中性,则所得溶液中c(NH4+)+c(Na+)+c(OH-)
考点:酸碱混合时的定性判断及有关ph的计算,常见阳离子的检验,常见阴离子的检验
专题:物质检验鉴别题,电离平衡与溶液的pH专题
分析:A、B、C、D是由下面的一种阳离子和一种阴离子组成的化合物(阳离子:NH4+、Na+、H+,阴离子:Cl-、CH3COO -、OH-),在水溶液中A、D能促进水的电离,说明AD是含弱离子能水解的盐,B、C能抑制水的电离,说明是酸或碱溶液,常温下各物质从1mL稀释到100mL;分析图象可知B可能为碱NaOH或NH3?H2O,由(4)分析可知,B为NaOH,C为酸,图象中稀释100倍,平衡减少2个单位,说明C为强酸HCl,D为盐水解呈酸性,应为NH4Cl溶液,所以A溶液为水解显碱性的盐溶液为CH3COONa;
(1)pH=10的A、B溶液中由水电离出的c(OH-)之比依据离子积常数计算分析;
(2)物质的量浓度为c1的X溶液与pH=3的C溶液等体积混合后得到单一的D溶液,说明X为NH3?H2O溶液,是弱碱溶液存在电离平衡分析判断,反应恰好进行一水合氨和氯化氢1:1反应判断;
(3)等浓度的A与C溶液等体积混合是醋酸钠和氯化氢反应生成醋酸的反应,反应后溶液中含有氯化钠和醋酸溶质,依据溶液中离子种类和性质分析离子浓度大小;
(4)若D与B稀溶液混合是氢氧化钠和氯化铵溶液混合,混合后呈中性结合溶液中离子电荷守恒分析判断.
(1)pH=10的A、B溶液中由水电离出的c(OH-)之比依据离子积常数计算分析;
(2)物质的量浓度为c1的X溶液与pH=3的C溶液等体积混合后得到单一的D溶液,说明X为NH3?H2O溶液,是弱碱溶液存在电离平衡分析判断,反应恰好进行一水合氨和氯化氢1:1反应判断;
(3)等浓度的A与C溶液等体积混合是醋酸钠和氯化氢反应生成醋酸的反应,反应后溶液中含有氯化钠和醋酸溶质,依据溶液中离子种类和性质分析离子浓度大小;
(4)若D与B稀溶液混合是氢氧化钠和氯化铵溶液混合,混合后呈中性结合溶液中离子电荷守恒分析判断.
解答:
解:依据题干信息分析,A、B、C、D是由下面的一种阳离子和一种阴离子组成的化合物(阳离子:NH4+、Na+、H+,阴离子:Cl-、CH3COO -、OH-),在水溶液中A、D能促进水的电离,说明AD是含弱离子能水解的盐,B、C能抑制水的电离,说明是酸或碱溶液,常温下各物质从1mL稀释到100mL;分析图象可知B可能为碱NaOH或NH3?H2O,由(4)分析可知,B为NaOH,C为酸,图象中稀释100倍,平衡减少2个单位,说明C为强酸HCl,D为盐水解呈酸性,应为NH4Cl溶液,所以A溶液为水解显碱性的盐溶液为CH3COONa;
(1)A溶液为CH3COONa,B为NaOH,pH=10的CH3COONa溶液中由水电离出的c(OH-)=
=10-4mol/L,pH=10的NaOH溶液中由水电离出的c(OH-)=10-10mol/L,pH=10的A、B溶液中由水电离出的c(OH-)之比为1:10-6 ,故答案为:1:10-6;
(2)物质的量浓度为c1的X溶液与pH=3的C溶液等体积混合后得到单一的D溶液为NH4Cl溶液,说明X为NH3?H2O溶液,是弱碱溶液存在电离平衡,溶液中c(OH-)<1×10-3mol/L,反应恰好进行一水合氨和氯化氢1:1反应,c1=1×10-3mol/L,
故答案为:<;=;
(3)等浓度的A与C溶液等体积混合是醋酸钠和氯化氢反应生成醋酸的反应,反应的离子方程式为:H++CH3COO-=CH3COOH;反应后溶液中含有氯化钠和醋酸溶质,溶液呈酸性,依据溶液中离子种类和性质分析离子浓度大小为c(Na+)=c(Cl-)>c(H+)>c(CH3COO-)>c(OH-),
故答案为:H++CH3COO-=CH3COOH;c(Na+)=c(Cl-)>c(H+)>c(CH3COO-)>c(OH-);
(4)若D与B稀溶液混合是氢氧化钠和氯化铵溶液混合,混合后呈中性,c(H+)=c(OH-),溶液中离子电荷守恒为c(Na+)+c(H+)+c(NH4+)=c(OH-)+c(Cl-);
得到c(NH4+)+c(Na+)+c(OH-)=c(Cl-)+c(H+),
故答案为:=.
(1)A溶液为CH3COONa,B为NaOH,pH=10的CH3COONa溶液中由水电离出的c(OH-)=
| 10-14 |
| 10-10 |
(2)物质的量浓度为c1的X溶液与pH=3的C溶液等体积混合后得到单一的D溶液为NH4Cl溶液,说明X为NH3?H2O溶液,是弱碱溶液存在电离平衡,溶液中c(OH-)<1×10-3mol/L,反应恰好进行一水合氨和氯化氢1:1反应,c1=1×10-3mol/L,
故答案为:<;=;
(3)等浓度的A与C溶液等体积混合是醋酸钠和氯化氢反应生成醋酸的反应,反应的离子方程式为:H++CH3COO-=CH3COOH;反应后溶液中含有氯化钠和醋酸溶质,溶液呈酸性,依据溶液中离子种类和性质分析离子浓度大小为c(Na+)=c(Cl-)>c(H+)>c(CH3COO-)>c(OH-),
故答案为:H++CH3COO-=CH3COOH;c(Na+)=c(Cl-)>c(H+)>c(CH3COO-)>c(OH-);
(4)若D与B稀溶液混合是氢氧化钠和氯化铵溶液混合,混合后呈中性,c(H+)=c(OH-),溶液中离子电荷守恒为c(Na+)+c(H+)+c(NH4+)=c(OH-)+c(Cl-);
得到c(NH4+)+c(Na+)+c(OH-)=c(Cl-)+c(H+),
故答案为:=.
点评:本题考查了盐类水解,弱电解质电离平衡,电解质溶液中离子浓度大小分析,溶液稀释和图象分析应用,掌握基础是关键,题目难度中等.

练习册系列答案
相关题目
有五瓶失去标签的溶液,分别为Na2CO3、AgNO3、BaCl2、HCl及NH4NO3.为鉴别它们,取其中一种溶液分别与剩余的4种溶液反应,则下列结论错误的是( )
| A、若有三支试管出现沉淀,则所取的溶液是AgNO3 |
| B、若均无现象,则所取的溶液是NH4NO3 |
| C、若一支试管出现气体,两支试管出现沉淀时,则所取的溶液是HCl |
| D、若有两支试管出现沉淀时,则后加入的可能是BaCl2溶液 |
萃取碘水中的碘,可用的萃取剂是( )
①酒精 ②汽油 ③四氯化碳.
①酒精 ②汽油 ③四氯化碳.
| A、只有③ | B、②③ |
| C、①③ | D、①②③ |
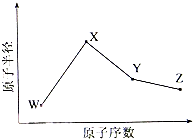 W、X、Y、Z是四种常见的短周期元素,其原子半径随原子序数变化如下图所示.已知W的一种核素的质量数为18,中子数为10;X和Ne原子的核外电子数相差1;Y的单质是一种常见的半导体材料;Z的非金属性在同周期主族元素中最大.
W、X、Y、Z是四种常见的短周期元素,其原子半径随原子序数变化如下图所示.已知W的一种核素的质量数为18,中子数为10;X和Ne原子的核外电子数相差1;Y的单质是一种常见的半导体材料;Z的非金属性在同周期主族元素中最大.