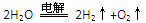题目内容
已知在298K时下列反应的反应热为:
(1)CH3COOH(l) + 2O2(g)=2CO2(g)+2H2O (l) △H1=-870.3KJ/mol
(2)C(s)+O2(g)=CO2(g) △H2=-393.5KJ/mol
(3)H2(g)+1/2O2(g)=H2O (l) △H3=-285.8KJ/mol
试计算下述反应的反应热:
2C(s) +2H2(g) +O2(g) =CH3COOH(l)
【答案】
-488.3KJ/mol
【解析】
试题分析:根据盖斯定律可知,(2)×2+(3)×3-(1)即得到反应
2C(s) +2H2(g) +O2(g) =CH3COOH(l)
所以该反应的反应热是△H=-285.8KJ/mol×2-393.5KJ/mol×2+870.3KJ/mol
=-488.3KJ/mol
考点:考查反应热的有关计算
点评:本题是基础性试题的考查,为中等难度的试题。主要是训练学生的规范答题能力,提高学习效率。同时也有利于培养学生的逻辑思维能力。

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目