题目内容
【题目】利用化学原理可以对工厂排放的废水,废渣等进行有效检测与合理处理。某工厂对制革工业污泥中部的处理工艺流程如下:
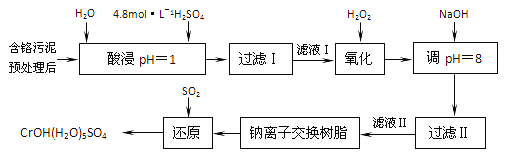
已知硫酸浸取液中的金属离子主要是Cr3+,其次是Fe3+、Al3+、Ca2+和Mg2+。
(1) 酸浸时,为了提高浸取率可采取的措施有_________、___________。(答出两点)。
(2)H2O2的作用是将滤液I中的Cr3+转化为Cr2O72-,则此反应中氧化剂和还原剂物质的量之比为_______。
(3)常温下,部分阳离子以氢氧化物形式沉淀时溶液的pH如下:
阳离子 | Fe3+ | Al3+ | Cr3+ |
开始沉淀时的pH | 2.7 | — | — |
沉淀完全时的pH | 3.7 | 5.4(>8溶解) | 9(>9溶解) |
①用NaOH调节溶液的pH不能超过8,其理由是________________。
②当pH=8时,Mg2+是否开始沉淀(溶液中镁高子浓度不超过1mol·L-1)。____(填“是”或“否”(已知Ksp[Mg(OH)2]=1.8×10-11)。
(4)上述流程中,加入NaOH溶液后,溶液呈碱性,Cr2O72-转化为CrO42-,写出上述流程中用SO2进行还原时发生反应的离子方程式_____________。
【答案】 升高温度(加热) 搅拌 3:2 pH超过8会使部分Al(OH)3溶解生成AlO2-![]() ,最终影响Cr回收与再利用 否 3SO2+2CrO42-+12H2O
,最终影响Cr回收与再利用 否 3SO2+2CrO42-+12H2O![]() 2CrOH(H2O)5SO4↓+SO42-+2OH-
2CrOH(H2O)5SO4↓+SO42-+2OH-
【解析】(1) 酸浸时,为了提高浸取率可采取的措施是延长浸取时间、加快溶解速度等措施,可以升高温度增大物质的溶解度或加快搅拌速度,因此本题答案为:升高温度(加热) ;搅拌。
(2)H2O2将Cr3+转化为Cr2O72-,H2O2作氧化剂,Cr3+被氧化,发生的反应为:2 Cr3++3 H2O2+H2O= Cr2O72-+8H+,氧化剂和还原剂物质的量之比为3:2。
(3)①pH=8时,Fe3+、Al3+已沉淀完全,滤液II中主要阳离子有:Na+、Mg2+、Ca2+ ,pH>8时, 会使部分Al(OH)3溶解生成AlO2-,会影响Cr回收与再利用。
②当pH=8时,c(Mg2+)![]() c2(OH-)=(Ksp[Mg(OH)2]=1.8×10-11,c(Mg2+)=
c2(OH-)=(Ksp[Mg(OH)2]=1.8×10-11,c(Mg2+)=![]() =
=![]() =18mol/L, 溶液中镁高子浓度不超过1mol·L-1,因此,此时Mg2+不沉淀。
=18mol/L, 溶液中镁高子浓度不超过1mol·L-1,因此,此时Mg2+不沉淀。
(4)流程中用SO2进行还原时,Na2 CrO4被还原CrOH(H2O)5SO4,SO2被氧化为SO42-,根据原子守恒写出反应的离子方程式:3SO2+2CrO42-+12H2O![]() 2CrOH(H2O)5SO4↓+SO42-+2OH-
2CrOH(H2O)5SO4↓+SO42-+2OH-

 阅读快车系列答案
阅读快车系列答案