题目内容
【题目】在t℃时,Ag2CrO4(橘红色)在水溶液中的沉淀溶解平衡曲线如图所示.又知AgCl的Ksp=1.8×10-10。下列说法不正确的是( )

A. t℃时,Y点和Z点时Ag2CrO4的Ksp相等
B. 饱和Ag2CrO4溶液中加入K2CrO4不能使溶液由Y点变为X点
C. t℃时,Ag2CrO4的Ksp为1×10-8
D. t℃时,将0.01mol·L-1 AgNO3溶液滴入20mL0.01mol·L-1 KCl和0.01mol·L-1 K2CrO4的混合溶液中,Cl-先沉淀
【答案】C
【解析】A、一定温度下溶度积是常数,随温度变化,不随浓度变化,所以t℃时,Y点和Z点时Ag2CrO4的Ksp相等,故A正确;B、在饱和Ag2CrO4溶液中加入K2CrO4仍为饱和溶液,点仍在曲线上,所以在饱和Ag2CrO4溶液中加入K2CrO4不能使溶液由Y点变为X点,故B正确;C、依据 图像曲线上的数据结合溶度积常数概念计算得到;曲线上的点是沉淀溶解平衡,Ag2CrO4的沉淀溶剂平衡为:Ag2CrO4(s)2Ag+CrO42-;Ksp=c2(Ag+)c(CrO42-)=(10-3)210-5=10-11;故C错误;D、依据溶度积常数计算Ksp(CrO42-)=c2(Ag+)c(CrO42-)=1×10-9;Ksp(AgCl)=c(Ag+)c(Cl-)=1.8×10-10,以0.01mol/L AgNO3溶液滴定20mL0.01mol/L,KCl和0.01mol/L的K2CrO4的混合溶液,c(CrO42-)=0.01mol/L,得到c(Ag+)=![]() =
=![]() ×10-4mol/L,0.01mol/L KCl溶液中,c(Cl-)=0.01mol/L;依据溶度积计算得到:c(Ag+)=
×10-4mol/L,0.01mol/L KCl溶液中,c(Cl-)=0.01mol/L;依据溶度积计算得到:c(Ag+)=![]() =1.8×10-8mol/L,所以先析出氯化银沉淀,故D正确;故选C。
=1.8×10-8mol/L,所以先析出氯化银沉淀,故D正确;故选C。

 口算题天天练系列答案
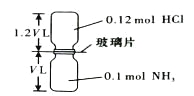
口算题天天练系列答案【题目】已知X、Y、Z、W均为中学化学中常见的单质或化合物,它们之间的转化关系如图所示(部分产物已略去)。则W、X不可能是
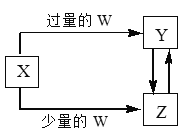
选项 | W | X |
A | 盐酸 | 碳酸钠溶液 |
B | 氢氧化钠溶液 | 氯化铝溶液 |
C | 二氧化碳 | 氢氧化钙溶液 |
D | 氯气 | 铁单质 |
A. A B. B C. C D. D
【题目】硼、镁及其化合物在工农业生产中应用广泛。已知:硼镁矿主要成分为Mg2B2O5H2O,硼砂的化学式为Na2B4O710H2O,利用硼镁矿制取金属镁及粗硼的工艺流程如下,请回答下列有关问题:
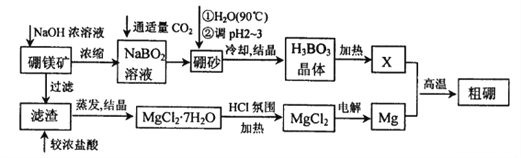
(1)硼砂中B的化合价为_________;滤渣的主要成分为_______________。
(2)X为H3BO3晶体加热脱水的产物,其与Mg制取粗硼的化学方程式为_________________________。
(3)H3BO3是一种一元弱酸,也可写作B(OH)3,它与水作用时结合水电离的OH-而呈酸性,这一变化的离子方程式为______________________________。
(4)MgCl2·6H2O需要在HCl氛围中加热,其目的是______________________。
(5)已知25℃时,Ksp[Mg(OH)2]=5.6×10-12;酸碱指示剂百里酚蓝变色的pH范围如下:
pH | <8.0 | 8.0~9.6 | >9.6 |
颜色 | 黄色 | 绿色 | 蓝色 |
在Mg(OH)2饱和溶液中滴加2滴百里酚蓝指示剂,溶液的颜色为_______________。
【题目】利用化学原理可以对工厂排放的废水,废渣等进行有效检测与合理处理。某工厂对制革工业污泥中部的处理工艺流程如下:
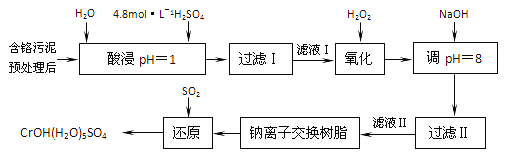
已知硫酸浸取液中的金属离子主要是Cr3+,其次是Fe3+、Al3+、Ca2+和Mg2+。
(1) 酸浸时,为了提高浸取率可采取的措施有_________、___________。(答出两点)。
(2)H2O2的作用是将滤液I中的Cr3+转化为Cr2O72-,则此反应中氧化剂和还原剂物质的量之比为_______。
(3)常温下,部分阳离子以氢氧化物形式沉淀时溶液的pH如下:
阳离子 | Fe3+ | Al3+ | Cr3+ |
开始沉淀时的pH | 2.7 | — | — |
沉淀完全时的pH | 3.7 | 5.4(>8溶解) | 9(>9溶解) |
①用NaOH调节溶液的pH不能超过8,其理由是________________。
②当pH=8时,Mg2+是否开始沉淀(溶液中镁高子浓度不超过1mol·L-1)。____(填“是”或“否”(已知Ksp[Mg(OH)2]=1.8×10-11)。
(4)上述流程中,加入NaOH溶液后,溶液呈碱性,Cr2O72-转化为CrO42-,写出上述流程中用SO2进行还原时发生反应的离子方程式_____________。