题目内容
6.有机物A的结构简式为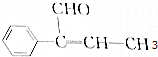 ,下列关于A的叙述中错误的是( )
,下列关于A的叙述中错误的是( )| A. | 在加热和催化剂作用下,能被氢气还原 | |
| B. | 能被高锰酸钾酸性溶液氧化 | |
| C. | 在一定条件下能与溴发生取代反应 | |
| D. | 不能与氢溴酸发生加成反应 |
分析 由结构可知,分子中含苯环、碳碳双键、-CHO,结合烯烃、醛的性质来解答.
解答 解:A.含苯环、碳碳双键、-CHO,在加热和催化剂作用下,能被氢气还原,故A正确;
B.含碳碳双键、-CHO,能被高锰酸钾酸性溶液氧化,故B正确;
C.苯环上H,在一定条件下能与溴发生取代反应,故C正确;
D.含碳碳双键,能与氢溴酸发生加成反应,故D错误;
故选D.
点评 本题考查有机物的结构与性质,为高频考点,把握官能团与性质的关系为解答的关键,侧重分析与应用能力的考查,注意烯烃、醛的性质及应用,题目难度不大.

练习册系列答案
 精英口算卡系列答案
精英口算卡系列答案 应用题点拨系列答案
应用题点拨系列答案 状元及第系列答案
状元及第系列答案
相关题目
16.用NA表示阿伏加德罗常数的值.下列叙述正确的是( )
| A. | 常温常压下的33.6L氯气与27g铝充分反应,转移电子数为3NA | |
| B. | 用CO2和O2组成的混合物中共有NA个分子,其中的氧原子数为2NA | |
| C. | Na2O2与H2O反应生成1.12L O2(标准状况),反应中转移的电子数为2×6.02×1023 | |
| D. | 标准状况下,80g SO3中含3NA个氧原子,体积约为22.4L |
17.某元素基态原子失去3个电子后,3d轨道半充满,其原子序数为( )
| A. | 24 | B. | 25 | C. | 26 | D. | 27 |
14.X、Y、Z、M、G五种主族元素分属三个短周期,且原子序数依次增大.X、Z同主族,可形成离子化合物 ZX;Y、M同主族,可形成 MY2、MY3两种分子.
请回答下列问题:
(1)Y在元素周期表中的位置为第二周期第ⅥA族;
(2)上述元素的最高价氧化物对应的水化物酸性最强的是HClO4(写化学式),非金属气态氢化物还原性最强的是H2S(写化学式);
(3)Y、G的单质或两元素之间形成的化合物可作水消毒剂的有Cl2、O3
(写出其中两种物质的化学式);
(4)ZX与水反应放出气体的化学方程式为NaH+H2O=NaOH+H2↑;
(5)探究同主族元素性质的一些共同规律,是学习化学的重要方法之一.元素 E位于第四周期,与元素 Y同主族.在下表中列出对 H2EO3各种不同化学性质的推测,举例并写出相应的化学方程式(化学方程式中 E用元素符号表示)
(6)由碳元素(C)、Y和 M三种元素组成的化合物 CYM中,所有原子的最外层满足 8电子结构.写出该化合物的电子式(电子式中 Y、M用元素符号表示)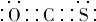 .
.
请回答下列问题:
(1)Y在元素周期表中的位置为第二周期第ⅥA族;
(2)上述元素的最高价氧化物对应的水化物酸性最强的是HClO4(写化学式),非金属气态氢化物还原性最强的是H2S(写化学式);
(3)Y、G的单质或两元素之间形成的化合物可作水消毒剂的有Cl2、O3
(写出其中两种物质的化学式);
(4)ZX与水反应放出气体的化学方程式为NaH+H2O=NaOH+H2↑;
(5)探究同主族元素性质的一些共同规律,是学习化学的重要方法之一.元素 E位于第四周期,与元素 Y同主族.在下表中列出对 H2EO3各种不同化学性质的推测,举例并写出相应的化学方程式(化学方程式中 E用元素符号表示)
| 编号 | 性质推测 | 化学方程式 |
| 示例 | 氧化性 | H2EO3+4HI═Z↓+2I2+3H2O |
| 1 | ||
| 2 |
 .
.
1.某溶液既能溶解Al(OH)3,又能溶解H2SiO3的溶液,在该溶液中可以大量共存的离子组是( )
| A. | K+、Na+、HCO${\;}_{3}^{-}$、NO3- | B. | Na+、SO${\;}_{4}^{2-}$、Cl-、ClO- | ||
| C. | H+、Mg2+、SO${\;}_{4}^{2-}$、NO3- | D. | Ag+、K+、NO3-、Na+ |
13.某学生用碱式滴定管量取0.1mol•L-1的NaOH溶液,开始时仰视液面读数为1.00mL,取出部分溶液后,俯视液面,读数为11.00mL,该同学在操作中实际取出的液体体积为( )

| A. | 大于10.00 mL | B. | 小于10.00 mL | C. | 等于10.00 mL | D. | 不能确定 |
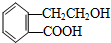 ,它可通过不同化学反应分别制得B、C、D和E四种物质.
,它可通过不同化学反应分别制得B、C、D和E四种物质.
 ;
;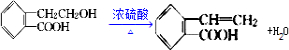 .
.