题目内容
11.能正确表示下列反应的离子方程式的是( )| A. | 用浓盐酸酸化的KMnO4溶液与H2O2反应,证明H2O2具有还原性:2MnO4-+6H++5H2O2═2Mn2++5O2↑+8H2O | |
| B. | 向次氯酸钙溶液通入过量CO2:Ca2++2ClO-+CO2+H2O═CaCO3↓+2HClO | |
| C. | 向次氯酸钙溶液通入SO2:Ca2++2ClO-+SO2+H2O═CaSO3↓+2HClO | |
| D. | FeBr2溶液与等物质的量的Cl2反应:2Fe2++2Br-+2Cl2═2Fe3++4Cl-+Br2 |
分析 A.盐酸具有还原性,能够被高锰酸钾氧化;
B.二氧化碳过量反应生成次氯酸和碳酸氢钙;
C.次氯酸根离子具有强的氧化性,能够氧化二氧化硫;
D.二价铁离子还原性强于溴离子,氯气先氧化二价铁离子再氧化溴离子.
解答 解:A.盐酸具有还原性,能够被高锰酸钾氧化,所以证明H2O2具有还原性不能用盐酸酸化高锰酸钾,故A错误;
B.向次氯酸钙溶液通入过量CO2,离子方程式:ClO-+CO2+H2O=HCO3-+HClO,故B错误;
C.向次氯酸钙溶液中通入少量SO2的离子反应为Ca2++2ClO-+H2O+SO2═CaSO4↓+H++Cl-+HClO,故C错误;
D.FeBr2溶液与等物质的量的Cl2反应,二价铁离子全部被氧化,溴离子部分被氧化,离子方程式:2Fe2++2Br-+2Cl2═2Fe3++4Cl-+Br2,故D正确;
故选:D.
点评 本题考查离子反应方程式的书写,明确发生的化学反应是解答本题的关键,并熟悉离子反应方程式的书写方法来解答,题目难度不大.

练习册系列答案
 小学课堂作业系列答案
小学课堂作业系列答案 金博士一点全通系列答案
金博士一点全通系列答案
相关题目
2.下列可逆反应达到平衡后,增大压强同时升高温度,平衡一定向右移动的是( )
| A. | 2AB(g)?A2(g)+B2(g)△H>0 | B. | A2(g)+3B2(g)?2AB3(g)△H<0 | ||
| C. | A(s)+B(g)?C(g)+D(g)△H>0 | D. | 2A(g)+B(g)?3C(g)+D(s)△H<0 |
6.在密闭容器中发生下列反应:aA(g)═cC(g)+dD(g),反应达到平衡后,将气体体积压缩到原来的一半,当再次达到平衡时,A的浓度为原平衡的2.1倍,则 a<c+d(填“>”、“=”或“<”).
16.下列装置的示意图均与电化学相关,有关叙述正确的是( ) 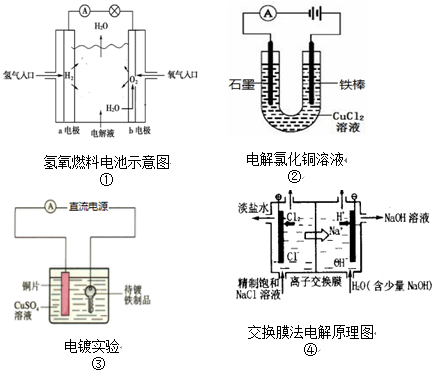

| A. | 装置①中,b极发生氧化反应 | |
| B. | 装置②中,铁棒上析出红色固体 | |
| C. | 装置③中,若电镀前两极金属的质量相等,电镀完成后二者质量差5.12g,则电镀时电路中的待镀铁制品应与电源负极相连,外电路转移的电子数为0.08mol | |
| D. | 装置④中,离子交换膜应为阴离子交换膜 |
3.下列实验仪器不能用来加热的是( )
| A. | 试管 | B. | 坩埚 | C. | 分液漏斗 | D. | 烧杯 |
1.向盛有饱和氯化钡溶液中通入SO2气体,再通入下列气体,能产生沉淀且沉淀组成相同的是( )
①NH3 ②NO2 ③H2S ④SO3 ⑤O2 ⑥Cl2 ⑦NO ⑧HCl.
①NH3 ②NO2 ③H2S ④SO3 ⑤O2 ⑥Cl2 ⑦NO ⑧HCl.
| A. | ①②⑥ | B. | ③④⑦ | C. | ②⑤⑦ | D. | ②④⑤⑥ |