题目内容
下列关于乙醇的说法正确的是( )
| A、可用作燃料 |
| B、属于高分子化合物 |
| C、不能发生氧化反应 |
| D、与乙酸互为同分异构体 |
考点:乙醇的化学性质
专题:有机反应
分析:乙醇结构简式为:CH3CH2OH,具有还原性,可燃烧或催化氧化,据此性质回答.
解答:
解:A.乙醇具有可燃性,燃烧放出大量热量,可用作燃料,如乙醇汽油等,故A正确;
B.乙醇分子量小,不是高分子化合物,故B错误;
C.乙醇具有还原性,可被氧化成乙醛或乙酸,故C错误;
D.乙醇分子式为C2H6O,乙酸分子式为C2H4O2,二者分子式不同,不是同分异构体,故D错误;
故选A.
B.乙醇分子量小,不是高分子化合物,故B错误;
C.乙醇具有还原性,可被氧化成乙醛或乙酸,故C错误;
D.乙醇分子式为C2H6O,乙酸分子式为C2H4O2,二者分子式不同,不是同分异构体,故D错误;
故选A.
点评:本题考查了乙醇的结构和性质,较基础,掌握乙醇的结构和性质即可.注意高分子化合物是指分子量达到10000以上的物质.

练习册系列答案
 世纪百通主体课堂小学课时同步达标系列答案
世纪百通主体课堂小学课时同步达标系列答案 世纪百通优练测系列答案
世纪百通优练测系列答案
相关题目
下列化学用语表达正确的是( )
A、Cl-的结构示意图: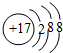 | ||
B、氯化氢分子的电子式: | ||
C、CH4Si的结构式: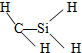 | ||
D、质量数为137的钡原子:
|
2SO2(g)+O2(g)?2SO3(g)是工业制硫酸的主要反应之一.一定温度下,在甲、乙、丙、丁四个容器体积均为2L的恒容密闭容器中投料,其起始物质的量及含硫反应物的平衡转化率如下表所示:
下列判断中,正确的是( )
| 甲 | 乙 | 丙 | 丁 | ||
| 起始物质的量 | n(SO2)/mol | 0.40 | 0 | 0.80 | 0.02 |
| n(O2)/mol | 0.24 | 0 | 0.48 | 0.04 | |
| n(SO3)/mol | 0 | 0.40 | 0 | 0.40 | |
| 含硫反应物的平衡转化率% | 80 | α1 | α2 | α3 | |
| A、乙中SO3的平衡转化率为α1=20% |
| B、平衡时,丙中c(SO3)是甲中的2倍 |
| C、平衡时,α3<α1 |
| D、该温度下,平衡常数的值为400 |
某有机化合物的结构简式如图 此有机化合物属于( )
此有机化合物属于( )
①烯烃 ②多官能团有机化合物 ③芳香烃 ④烃的衍生物 ⑤高分子化合物 ⑥酚类.
 此有机化合物属于( )
此有机化合物属于( )①烯烃 ②多官能团有机化合物 ③芳香烃 ④烃的衍生物 ⑤高分子化合物 ⑥酚类.
| A、①②③④ | B、②④ |
| C、②④⑤ | D、①③⑤⑥ |
下列离子方程式书写正确的是( )
| A、过量氯气通入溴化亚铁溶液中:3Cl2+2Fe2++4Br-=6Cl-+2Fe3++2Br2 |
| B、FeCl3溶液与Cu的反应:Cu+Fe3+=Cu2++Fe2+ |
| C、NO2与水的反应:3NO2+H2O=2NO3-+NO+2H+ |
| D、NH4HCO3溶于过量的NaOH溶液中:HCO3-+OH-=CO32-+H2O |
有机物M的结构简式为: 有关M的下列叙述中正确的是( )
有关M的下列叙述中正确的是( )
 有关M的下列叙述中正确的是( )
有关M的下列叙述中正确的是( )| A、可与H2反应,1 mol M最多消耗5 mol H2 |
| B、可与浓溴水反应,1 mol M最多消耗4 mol Br2 |
| C、可与NaOH溶液反应,1 mol M最多消耗3 mol NaOH |
| D、常温下,M在水中的溶解度小于苯酚在水中的溶解度 |
铅笔是常用的学习用品,铅笔芯的主要成分是石墨和黏土.某型号的铅笔芯质量的一半成分是石墨,用该铅笔写一个化学方程式消耗的质量约1mg,那么铅笔芯中减少的碳原子数约为( )
| A、2.5×1019个 |
| B、2.5×1022个 |
| C、5×1019个 |
| D、5×1022个 |
下列有关说法正确的是( )
| A、丁达尔现象不是胶体特有的,溶液也具备 |
| B、欲配制1.00 L 1.00 mol?L-1的NaCl溶液,可将58.5g NaCl溶于1.00 L水中 |
| C、质子数为53,中子数为78的碘原子可表示为:131 53I |
| D、煤的干馏和石油的分馏均属化学变化 |



