题目内容
石蜡油(17个碳原子以上的液态烷烃混合物)的分解实验装置如图所示(部分仪器已省略)。在试管①中加入石蜡油和氧化铝(催化石蜡分解);试管②放在冷水中,试管③中加入溴水。

实验现象:
试管①中加热一段时间后,可以看到试管内液体沸腾;
试管②中有少量液体凝结,闻到汽油的气味,往液体中滴加几滴高锰酸钾酸性溶液颜色褪去。根据实验现象回答下列问题:
(1) 装置A的作用是______________________________
(2) 试管①中发生的主要反应有:
C17H36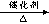 C8H18+C9H18 C8H18
C8H18+C9H18 C8H18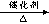 C4H10+C4H8
C4H10+C4H8
丁烷可进一步裂解,除得到甲烷和乙烷外,还可以得到另两种有机物,它们的结构简式为_____________和________________,这两种有机物混合后在一定条件下可聚合成高分子化合物,其反应类型属于________反应。其可能结构为( )(答案可能不止一个,下同)
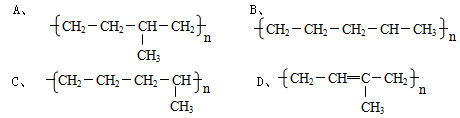
(3)写出试管③中反应的一个化学方程式_____________________________,该反应的类型为__________反应。
(4)试管②中的少量液体的组成是____________(填序号)
①甲烷 ②乙烯 ③液态烷烃 ④液态烯烃

实验现象:
试管①中加热一段时间后,可以看到试管内液体沸腾;
试管②中有少量液体凝结,闻到汽油的气味,往液体中滴加几滴高锰酸钾酸性溶液颜色褪去。根据实验现象回答下列问题:
(1) 装置A的作用是______________________________
(2) 试管①中发生的主要反应有:
C17H36
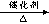 C8H18+C9H18 C8H18
C8H18+C9H18 C8H18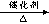 C4H10+C4H8
C4H10+C4H8丁烷可进一步裂解,除得到甲烷和乙烷外,还可以得到另两种有机物,它们的结构简式为_____________和________________,这两种有机物混合后在一定条件下可聚合成高分子化合物,其反应类型属于________反应。其可能结构为( )(答案可能不止一个,下同)
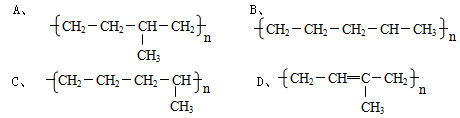
(3)写出试管③中反应的一个化学方程式_____________________________,该反应的类型为__________反应。
(4)试管②中的少量液体的组成是____________(填序号)
①甲烷 ②乙烯 ③液态烷烃 ④液态烯烃
(1)防止试管③中的液体倒吸到试管②中
(2)CH2=CH2、CH3CH=CH2,加聚,AC
(3)CH2=CH2+Br2→CH2BrCH2Br(CH3CH=CH2+Br2→CH3CHBrCH2Br),加成
(4)③④
(2)CH2=CH2、CH3CH=CH2,加聚,AC
(3)CH2=CH2+Br2→CH2BrCH2Br(CH3CH=CH2+Br2→CH3CHBrCH2Br),加成
(4)③④
考查石油的催化裂化及烃的性质
(1)试管A的玻璃管进口与出口均较短,一般起安全瓶的作用,可防止试管③中的液体倒吸到试管②中
(2)烷烃分解一般可得到相同碳原子的烷烃及烯烃,故丁烷分解可得到:
C4H10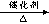 CH4+C3H6 C8H18
CH4+C3H6 C8H18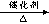 C2H6+C2H4
C2H6+C2H4
所以,丁烷可分解得到甲烷、乙烷、乙烯CH2=CH2、及丙烯CH3CH=CH2
其中乙烯、丙烯可发生加聚反应得到高分子化合物,除自身加聚生成 、
、 外,还可混合加聚,生成
外,还可混合加聚,生成 及
及
(3)乙烯或丙烯可与溴发生加成反应:CH2=CH2+Br2→CH2BrCH2Br、CH3CH=CH2+Br2→CH3CHBrCH2Br
(4)在冷水冷凝作用下,沸点较高的(碳原子大于4)烃被液化为液态,故答案为③④
(1)试管A的玻璃管进口与出口均较短,一般起安全瓶的作用,可防止试管③中的液体倒吸到试管②中
(2)烷烃分解一般可得到相同碳原子的烷烃及烯烃,故丁烷分解可得到:
C4H10
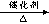 CH4+C3H6 C8H18
CH4+C3H6 C8H18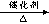 C2H6+C2H4
C2H6+C2H4所以,丁烷可分解得到甲烷、乙烷、乙烯CH2=CH2、及丙烯CH3CH=CH2
其中乙烯、丙烯可发生加聚反应得到高分子化合物,除自身加聚生成
 、
、 外,还可混合加聚,生成
外,还可混合加聚,生成 及
及
(3)乙烯或丙烯可与溴发生加成反应:CH2=CH2+Br2→CH2BrCH2Br、CH3CH=CH2+Br2→CH3CHBrCH2Br
(4)在冷水冷凝作用下,沸点较高的(碳原子大于4)烃被液化为液态,故答案为③④

练习册系列答案
 期末冲刺100分创新金卷完全试卷系列答案
期末冲刺100分创新金卷完全试卷系列答案
相关题目
 -
-
