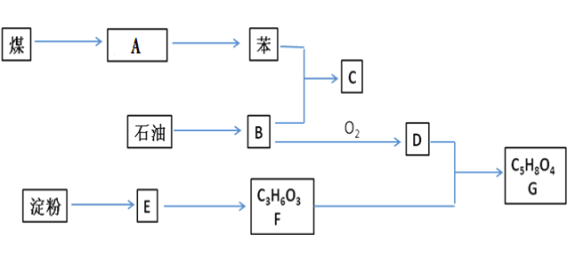
题目内容
【题目】下列关于电解的知识叙述中,错误的是
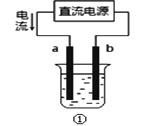
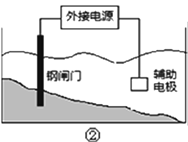
A.用装置①精炼铜,则a极为粗铜,电解质溶液可为CuSO4溶液
B.工业上通过电解氯化钠溶液的方法制备金属钠
C.装置②的钢闸门应与外接电源的负极相连
D.向电子元件上镀上一层银,常需要电子元件做阴极,金属银作阳极
【答案】B
【解析】
A. 由电流移动方向可知,装置①a是阳极、b是阴极,用装置①精炼铜,粗铜作阳极,电解质溶液可为CuSO4溶液,故A正确;
B.电解氯化钠溶液生成氢氧化钠、氢气、氯气,工业上通过电解熔融氯化钠制备金属钠,故B错误;
C. 金属保护可采用外接电流阴极保护法,装置②的钢闸门应与外接电源的负极相连,故C正确;
D. 电镀时,镀件作阴极,向电子元件上镀上一层银,常需要电子元件作阴极,金属银作阳极,故D正确;
答案选B。

 阳光课堂课时优化作业系列答案
阳光课堂课时优化作业系列答案【题目】研究不同 pH 时 CuSO4 溶液对 H2O2 分解的催化作用。资料:a.Cu2O 为红色固体,难溶于水,能溶于硫酸,生成 Cu 和Cu2+。b.CuO2 为棕褐色固体,难溶于水,能溶于硫酸,生成 Cu2+和 H2O2。c.H2O2 有弱酸性:H2O2 ![]() H+ +HO2-,HO2-
H+ +HO2-,HO2- ![]() H+ +O22-。
H+ +O22-。
编号 | 实验 | 现象 |
Ⅰ | 向 1 mL pH=2 的 1 mol·L 1 CuSO4溶液中加入 0.5 mL 30% H2O2 溶液 | 出现少量气泡 |
Ⅱ | 向 1 mL pH=3 的 1 mol·L 1 CuSO4溶液中加入 0.5 mL 30% H2O2 溶液 | 立即产生少量棕黄色沉淀,出现较明显气泡 |
Ⅲ | 向 1 mL pH=5 的 1 mol·L 1CuSO4溶液中加入 0.5 mL 30% H2O2 溶液 | 立即产生大量棕褐色沉淀,产生大量气泡 |
(1) 经检验生成的气体均为 O2,Ⅰ中 CuSO4 催化分解 H2O2 的化学方程式是__。
(2)对Ⅲ中棕褐色沉淀的成分提出 2 种假设:ⅰ.CuO2,ⅱ.Cu2O 和CuO2 的混合物。为检验上述假设,进行实验Ⅳ:过滤Ⅲ中的沉淀,洗涤,加入过量硫酸,沉淀完全溶解,溶液呈蓝色,并产生少量气泡。
①若Ⅲ中生成的沉淀为 CuO2,其反应的离子方程式是__。
②依据Ⅳ中沉淀完全溶解,甲同学认为假设ⅱ不成立,乙同学不同意甲同学的观点,理由是__。
③为探究沉淀中是否存在 Cu2O,设计如下实验:
将Ⅲ中沉淀洗涤、干燥后,取 a g 固体溶于过量稀硫酸,充分加热。冷却后调节溶液 pH,以 PAN 为指示剂,向溶液中滴加 c mol·L 1EDTA 溶液至滴定终点,消耗 EDTA 溶液 V mL。V=__,可知沉淀中不含 Cu2O,假设ⅰ成立。(已知:Cu2++EDTA= EDTA-Cu2+,M(CuO2)=96 g·mol 1,M(Cu2O)=144 g·mol1)
(3)结合方程式,运用化学反应原理解释Ⅲ中生成的沉淀多于Ⅱ中的原因__ 。
(4)研究Ⅰ、Ⅱ、Ⅲ中不同 pH 时 H2O2 分解速率不同的原因。
实验Ⅴ:在试管中分别取 1 mL pH=2、3、5 的 1 mol·L1 Na2SO4 溶液,向其中各加入 0.5 mL 30% H2O2 溶液,三支试管中均无明显现象。
实验Ⅵ:__(填实验操作和现象),说明 CuO2 能够催化 H2O2 分解。
(5)综合上述实验,Ⅰ、Ⅱ、Ⅲ中不同 pH 时 H2O2 的分解速率不同的原因是__。