题目内容
9.水煤气 (主要成分:CO、H2 ) 是重要燃料和化工原料,可用水蒸气通过炽热的炭层制得:C (s)+H2O(g)?CO (g)+H2 (g);△H=+131.3kJ•mol-1
(1)某温度下,四个容器中均进行着上述反应,各容器中炭足量,其它物质的物质的量浓度及正逆反应速率关系如下表所示.请填写表中相应的空格.
| 容器编号 | c(H2O)/mol•L-1 | c(CO)/mol•L-1 | c(H2)/mol•L-1 | V正、V逆比较 |
| Ⅰ | 0.06 | 0.60 | 0.10 | V正=V逆 |
| Ⅱ | 0.06 | 0.50 | 0.40 | ? |
| Ⅲ | 0.12 | 0.40 | 0.80 | V正<V逆 |
| Ⅳ | 0.12 | 0.30 | ? | V正=V逆 |
(3)己知:C (s)+$\frac{1}{2}$O2(g)═CO (g);△H=-110.5kJ•mo1-1
CO(g)+$\frac{1}{2}$O2(g)═CO2 (g);△H=-283.0kJ•mo1-1
H2 (g)+$\frac{1}{2}$O2 (g)═H2O (g);△H=-241.8kJ•mo1-1
那么,将2.4g 炭完全转化为水煤气,然后再燃烧,整个过程△H=-78.7kJ•mo1-1.
分析 (1)I处于平衡状态,根据K=$\frac{c(CO)×c({H}_{2})}{c({H}_{2}O)}$计算平衡常数,再计算Ⅱ中浓度商Qc,若Qc=K,处于平衡状态,若Qc>K,反应向逆反应方向进行,若Qc<K,反应向正反应方向进行;
Ⅳ也处于平衡状态,根据平衡常数计算氢气的浓度;
(2)恒温恒压下,向其中加入1.0mol炭和 1.0mo l水蒸气 (H216O),发生上述反应,达到平衡时,容器的体积变为原来的1.25 倍,平衡时混合气体总物质的量为1mol×1.25=1.25mol,由方程式可知消耗1mol水蒸气混合气体物质的量增大1mol,故反应的水蒸气为1.25mol-1mol=0.25mol,进而计算平衡时水蒸气的转化率;
向该容器中补充 a mol 炭,平衡不移动,水蒸气的转化率不变,再补充 a mol 水蒸气 (H218O),恒温恒压下,与原平衡为等效平衡,平衡时水蒸气转化率相同,根据水的转化率计算生成CO物质的量;
(3)计算2.4gC与水反应生成的CO和H2的物质的量,根据热化学方程式,计算2.4gC生成水煤气吸收的热量,CO、氢气燃烧放出的热量,进而计算整个过程放出的热量,可得整个过程的焓变.
解答 解:(1)Ⅰ达到平衡状态,平衡常数K=$\frac{c(CO)×c({H}_{2})}{c({H}_{2}O)}$=$\frac{0.6×0.1}{0.06}$=1,
Ⅱ中Qc=$\frac{0.4×0.5}{0.06}$=3.33>1,则反应向逆反应方向移动,即V正<V逆,
反应Ⅳ中V正=V逆,说明反应达平衡状态,则有$\frac{0.3×c({H}_{2})}{0.12}$=1,解得c(H2)=0.4mol/L,
故答案为:容器Ⅱ:>;容器Ⅳ:0.4;
(2)恒温恒压下,向其中加入1.0mol炭和 1.0mo l水蒸气 (H216O),发生上述反应,达到平衡时,容器的体积变为原来的1.25 倍,平衡时混合气体总物质的量为1mol×1.25=1.25mol,由方程式可知消耗1mol水蒸气混合气体物质的量增大1mol,故反应的水蒸气为1.25mol-1mol=0.25mol,平衡时水蒸气的转化率为$\frac{0.25mol}{1mol}$×100%=25%;
增加固体碳,对反应速率和化学平衡都没有影响,水蒸气的转化率不变;
恒温恒压下,再补充 a mol 水蒸气 (H218O),平衡状态不变,为等效平衡,水的转化率相等,则有生成的C18O 的物质的量为a×25%=0.25a,原平衡时生成的C16O为0.25mol,则C16O和C18O 的物质的量之比为0.25:0.25a=1:a,
故答案为:25%;不变;1:a;
(3)n(C)=$\frac{2.4g}{12g/mol}$=0.2mol,与水反应生成0.2molCO和0.2molH2,反应吸收的热量为0.2mol×131.3KJ/mol=26.26KJ,
0.2molCO完全燃烧放出的热量为0.2mol×283KJ/mol=56.6KJ,
0.2molH2完全燃烧放出的热量为0.2mol×241.8KJ/mol=48.36KJ,
所以将2.4g 炭完全转化为水煤气,然后再燃烧,整个过程放出的热量为56.6KJ+48.36KJ-26.26KJ=78.7KJ,
故整个过程△H=-78.7kJ•mol-1,
故答案为:-78.7.
点评 本题考查化学平衡计算与影响因素、平衡常数应用、反应热计算等,难度中等.

 活力课时同步练习册系列答案
活力课时同步练习册系列答案| A. | 分类法是学习和研究化学物质及化学变化的一种科学方法 | |
| B. | 常见的分类方法有交叉分类法和树形分类法 | |
| C. | 对于相同的分类对象,采用的分类标准不同,分类的结果也不同 | |
| D. | 初中的化学知识告诉我们,化学反应可以分为化合反应和分解反应两大类 |
| A. | MgO | B. | FeCl2 | C. | CO | D. | H2O |
| 物质 | CH3OH | CH3OCH3 | H2O |
| 浓度(mol•L-1) | 0.44 | 0.6 | 0.6 |
| A. | 该反应的平衡常数表达式为:K=[c(CH3OCH3)×c(H2O)]/c(CH3OH) | |
| B. | 此时正、逆反应速率的大小:v正<v逆 | |
| C. | 若加入CH3OH后,经10 min达到平衡,此时c(CH3OH)=0.04 mol/L | |
| D. | 10 min达到平衡时,反应速率v(CH3OH)=1.6 mol/(L•min) |
 已知在25℃时,醋酸、碳酸和亚硫酸的电离平衡常数如下表:
已知在25℃时,醋酸、碳酸和亚硫酸的电离平衡常数如下表:| 醋酸 | 碳酸 | 亚硫酸 |
| Ka=1.75×10-5 | Ka1=4.30×10-7 Ka2=5.61×10-11 | Ka1=1.54×10-2 Ka2=1.02×10-7 |
(2)在相同条件下,试比较H2CO3、HCO3-和HSO3-的酸性强弱:H2CO3>HSO3->HCO3-.
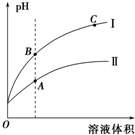
(3)如图表示常温时稀释醋酸、碳酸两种酸的稀溶液时,溶液PH随水量的变化图象中,曲线I表示的酸是CH3COOH(填化学式).
②a、b、c三点中,水的电离程度最大的是C(填字母).
| A. | CuO→Cu | B. | MnO4-→Mn2+ | C. | Na2SO3→Na2SO4 | D. | Cl2→Cl- |
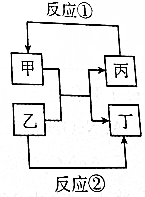 甲、乙、丙、丁四种取值的相互转化关系如图所示(部分反应物、产物及反应条件已略去).已知甲为常见金属(Na、Mg、Al、Fe、Cu)或其氧化物,回答下列问题:
甲、乙、丙、丁四种取值的相互转化关系如图所示(部分反应物、产物及反应条件已略去).已知甲为常见金属(Na、Mg、Al、Fe、Cu)或其氧化物,回答下列问题: 在一定量的石灰乳中通入一定量的氯气,二者恰好完全反应(发生的反应均为放热反应).生成物中含有Cl-、C1O-、C1O3-三种含氯元素的离子,其中C1O-、C1O3-两种离子的物质的量(n)与反应时间(t)的曲线如图所示.
在一定量的石灰乳中通入一定量的氯气,二者恰好完全反应(发生的反应均为放热反应).生成物中含有Cl-、C1O-、C1O3-三种含氯元素的离子,其中C1O-、C1O3-两种离子的物质的量(n)与反应时间(t)的曲线如图所示.