题目内容
室温下向10mL pH=3的醋酸溶液中加入水稀释后,下列说法正确的是( )
| A、溶液中导电粒子的数目减少 | ||
B、溶液中
| ||
| C、醋酸的电离程度增大,c(H+)亦增大 | ||
| D、完全中和醋酸需加入10mLpH=11的NaOH溶液 |
考点:弱电解质在水溶液中的电离平衡
专题:
分析:根据醋酸是弱电解质,则室温下向10mLpH=3的醋酸溶液中加水稀释将促进电离,离子的数目增多,但溶液的体积增大,则电离产生的离子的浓度减小,并利用温度与电离常数的关系、酸碱混合时pH的计算来解答.
解答:
解:A、因醋酸溶液中加水稀释,促进电离,则液中导电粒子的数目增多,故A错误;
B、因为
=
=
,温度不变,Ka、Kw都不变,则
不变,故B正确;
C、加水稀释时,醋酸的电离平衡正移,电离程度增大,溶液的体积增大的倍数大于n(H+)增加的倍数,则c(H+)减小,故C错误;
D、等体积10mLpH=3的醋酸与pH=11的NaOH溶液混合时,醋酸的浓度大于0.001mol/L,醋酸过量,则溶液的pH<7,故D错误;
故选B.
B、因为
| [CH3COO-] |
| [CH3COO-]?[OH-] |
| [CH3COO-]?[H+] |
| [CH3COOH]?KW |
| Ka |
| KW |
| [CH3COO-] |
| [CH3COOH]?[OH-] |
C、加水稀释时,醋酸的电离平衡正移,电离程度增大,溶液的体积增大的倍数大于n(H+)增加的倍数,则c(H+)减小,故C错误;
D、等体积10mLpH=3的醋酸与pH=11的NaOH溶液混合时,醋酸的浓度大于0.001mol/L,醋酸过量,则溶液的pH<7,故D错误;
故选B.
点评:本题考查弱电解质的稀释,明确温度与电离平衡常数的关系、溶液的pH与物质的量浓度的关系、稀释中溶液体积的变化与离子的物质的量的变化程度是解答本题的关键.

练习册系列答案
 字词句段篇系列答案
字词句段篇系列答案
相关题目
某同学欲配制下列含有四种不同阴、阳离子的溶液,其中能配制成功的是( )
| A、Ca2+、H+、Cl-、HCO3- |
| B、Mg2+、Al3+、Cl-、SO42- |
| C、Na+、H+、NO3-、OH- |
| D、NH4+、Ag+、HCO3-、OH- |
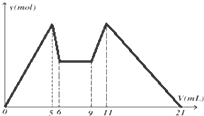 如图是向MgCl2、AlCl3混合溶液中,先后加入试剂A、B时所得沉淀物质的量y(mol) 与试剂体积V(mL)间的关系图.开始滴加6mL试剂A后继续滴加A若干,之后改滴试剂B.以下结论正确的是( )
如图是向MgCl2、AlCl3混合溶液中,先后加入试剂A、B时所得沉淀物质的量y(mol) 与试剂体积V(mL)间的关系图.开始滴加6mL试剂A后继续滴加A若干,之后改滴试剂B.以下结论正确的是( )| A、可能是NaOH,B可能是盐酸,且2C(A)=C(B) |
| B、若A和B均为一元强酸或一元强碱,则滴加7mL试剂A后改滴试剂B |
| C、A可能是Ba(OH)2,B可能是硫酸,且C(A)=C(B) |
| D、原混合液中,c(Al3+):c(Mg2+):c(Cl-)=1:2:7 |
下列溶液中各微粒的浓度关系不正确的是( )
| A、0.1mol?L-1 HCOOH溶液中:c(HCOO-)+c(OH-)=c(H+) |
| B、0.1mol?L-1 NH4Cl溶液中:c(NH4+)+c(NH3?H2O)=c(Cl-) |
| C、0.1mol?L-1NaHCO3溶液中:c(Na+)+c(H+)+c(H2CO3)=c(HCO3-)+c(CO32-)+c(OH-) |
| D、等体积、等物质的量浓度的CH3COONa和弱酸CH3COOH混合后的溶液中:c(CH3COO-)-c(CH3COOH)=2c(H+)-2c(OH-) |
已知0.1mol?L-1CH3COOH溶液的pH=3,溶液中存在CH3COOH?CH3COO-+H+,下列有关说法正确的是( )
A、加水稀释,溶液中
| ||
| B、加水稀释100倍时,溶液的pH=5 | ||
| C、升温或加入少量NaOH(s)均促进电离,其电离常数不变 | ||
| D、加NaOH溶液,当混合液的pH=7时,溶液中c(Na+)=c(CH3COO-) |
某温度下,C和H2O(g)在密闭容器里发生下列反应:C(s)+H2O(g)?CO(g)+H2(g),CO(g)+H2O(g)?CO2(g)+H2(g),达到平衡时,c(H2)=1.9mol?L-1,c(CO)=0.1mol?L-1.则下列叙述正确的有( )
| A、CO在平衡时转化率为10% |
| B、其他条件不变,缩小体积,H2O(g)的转化率降低 |
| C、平衡浓度c(CO2)=c(H2) |
| D、平衡时气体平均相对分子质量约为23.3 |
下列各组离子在溶液中能大量共存的是( )
| A、Fe3+、SCN-、Na+、Cl- |
| B、Cl-、AlO2-、HCO3-、Na+ |
| C、Fe2+、NH4+、SO42-、S2- |
| D、Ca2+、HCO3-、Cl-、K+ |
胶体区别于其他分散系的本质特征是( )
| A、胶体的分散质能通过滤纸空隙,而浊液的分散质不能 |
| B、分散质粒子直径在10-9~10-7m之间 |
| C、胶体能产生丁达尔现象 |
| D、胶体是纯净物,气体分散系是混合物 |