题目内容
5.合成氨工业、硫酸工业的生产工艺流程大致为: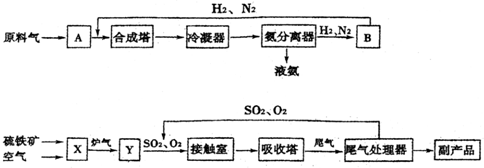
合成塔和接触室中的反应分别为:
N2(g)+3H2(g)?2NH3(g)△H=0;2SO2(g)+O2(g)?2SO2(g)△H=0.
(1)写出流程中设备的名称:B循环压缩机,X沸腾炉.
(2)进入合成塔和接触室中的气体都要进行热处理,最理想的热处理方法是充分利用反应中放出的热量加热反应气.
(3)采用循环操作可提高原料的利用率,下列生产中,采用循环操作的是①②③(填序
号).
①硫酸工业 ②合成氨工业 ③硝酸工业
(4)工业上常用98.3%的浓硫酸吸收SO3而不用稀硫酸或水的原因是由于用稀硫酸或水吸收SO2时易形成酸雾,不利于SO2吸收.
(5)工业生产中常用氨--酸法进行尾气脱硫,以达到消除污染、废物利用的目的.硫酸工业尾气中的SO2经处理可以得到一种化肥,该肥料的化学式是(NH4)2SO4.
(6)根据化学平衡移动原理,下列条件或措施合理的是③④(填序号).
①合成氨工业在高压下进行 ②合成氨工业和硫酸工业都使用催化剂 ③及时将氨液化而分离 ④硫酸工业中,净化后的炉气中要有过量空气 ⑤合成氨工业和硫酸工业都采用适宜的温度.
分析 (1)工业合成氨通过循环压缩机循环使用分离出氮气和氢气、接触法制硫酸的工业流程中煅烧黄铁矿的设备为沸腾炉;
(2)依据合成塔中的反应要吸热,接触室中的反应要放热,结合节约能源提高经济效益的理念解答;
(3)①硫酸工业中在接触室发生了二氧化硫的催化氧化,采用循环操作可提高二氧化硫的利用率;
②合成氨生产中产生了氨气,采用循环操作可提高N2、H2的转化率;
③硫酸工业中涉及到合成氨,合成氨生产中产生了氨气,采用循环操作可提高N2、H2的转化率;
(4)不能用水吸收三氧化硫而用98.3%的浓硫酸,若用水或稀硫酸吸收,轻易形成酸雾,且吸收速度慢;
(5)工业生产中常用氨-酸法进行尾气脱硫,即先用氨水吸收,再用浓硫酸处理.先用氨水吸收时,发生反应:SO2+2NH3•H2O═(NH4)2SO3,再用浓硫酸处理时,发生反应:(NH4)2SO3+H2SO4═(NH4)2SO4+SO2↑+H2O;
(6)温度、浓度、压强均对化学平衡移动有影响,合成氨反应、二氧化硫与氧气反应生成三氧化硫都是为放热的体积减小的反应.
解答 解:(1)合成氨工业中,利用氨易液化,分离出N2、H2通过循环压缩机循环使用,可提高氨的产率;X设备是煅烧黄铁矿的设备,在沸腾炉进行反应,
故答案为:循环压缩机;沸腾炉;
(2)合成塔中的反应要吸热,接触室中的反应要放热,可以充分利用反应中放出的热量加热反应气,实现节越能源提高经济效益的目的;
故答案为:充分利用反应中放出的热量加热反应气;
(3)①硫酸工业中在接触室发生了二氧化硫的催化氧化,采用循环操作可提高二氧化硫的利用率,故①正确;
②合成氨生产中产生了氨气,采用循环操作可提高N2、H2的转化率,故②正确;
③硫酸工业中涉及到合成氨,合成氨生产中产生了氨气,采用循环操作可提高N2、H2的转化率,故③正确;
故选:①②③;
(4)不能用水吸收三氧化硫而用98.3%的浓硫酸,若用水或稀硫酸吸收,轻易形成酸雾,且吸收速度慢;
故答案为:由于用稀硫酸或水吸收SO2时易形成酸雾,不利于SO2吸收;
(5)工业生产中常用氨-酸法进行尾气脱硫,即先用氨水吸收,再用浓硫酸处理.先用氨水吸收时,发生反应:SO2+2NH3•H2O═(NH4)2SO3,再用浓硫酸处理时,发生反应:(NH4)2SO3+H2SO4═(NH4)2SO4+SO2↑+H2O,硫酸工业尾气中的SO2经处理可以得到一种化肥为(NH4)2SO4;
故答案为:(NH4)2SO4;
(6)合成氨反应、二氧化硫与氧气反应生成三氧化硫都是为放热的体积减小的反应,
①合成氨工业在高压下进行,加压有利于平衡向正方向移动,但是对设备强度要求高,应采用适当的高压,故不选;
②合成氨工业和硫酸工业都使用催化剂,使用催化剂不影响平衡的移动,故不选;
③及时将氨液化而分离,减小生成物浓度,使平衡向正方向移动,有利于产品的生成,故选;
④硫酸工业中,净化后的炉气中要有过量空气,增大空气的用量能够提高二氧化硫的转化率,故选;
⑤合成氨反应、二氧化硫与氧气反应生成三氧化硫都是为放热,从平衡角度,低温有利于平衡向正向移动,但是低温反应速率慢,不利于经济效益的提高,故不选;
故选:③④.
点评 本题主要考查了合成氨工业、硫酸工业的生产工艺流程,掌握生产的原理和步骤、熟悉平衡移动的影响因素和影响反应速率的因素是解题的关键,题目难度中等.

| A. | 加锌盐 | B. | 加碘盐 | C. | 加钙盐 |
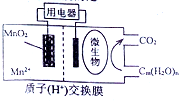 如图为一种微生物燃料电池结构示意图,关于该电池叙述正确的是( )
如图为一种微生物燃料电池结构示意图,关于该电池叙述正确的是( )| A. | 分子组成为Cm(H2O)n的物质一定是糖类 | |
| B. | 正极反应式为:MnO2+4H++2e-=Mn2++2H2O | |
| C. | 放电过程中,H+从正极区移向负极区 | |
| D. | 若Cm(H2O)n是葡萄糖,当电路中转移了6NA电子时,反应的葡萄糖质量是60g. |
| A. | 原子半径:W>Z>Y>X>M | |
| B. | XZ2、X2M2、W2Z2均为直线型的共价化合物 | |
| C. | 常温下W与H形成的化合物1mol与水完全反应生成气体的质量为2克 | |
| D. | 由X、Y、Z、M四种元素形成的化合物一定既有离子键,又有共价键 |
| A. | Cl2和SO2 | B. | CO2和NH3 | C. | NO和SO2 | D. | NO2和SO2 |

 .
. +
+ $\stackrel{H+}{?}$
$\stackrel{H+}{?}$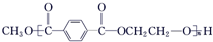 +(2n-1)CH3OH;G的同分异构体有多种,则满足下列条件的共有12种.
+(2n-1)CH3OH;G的同分异构体有多种,则满足下列条件的共有12种. 合成
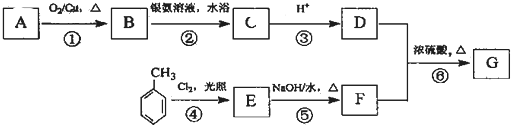
合成 的流程图(写出反应物和反应条件).注:书写格式参照如下示例流程图:
的流程图(写出反应物和反应条件).注:书写格式参照如下示例流程图: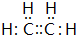 ,A的结构简式H2C=CH2.
,A的结构简式H2C=CH2. ,写出B的一种含三键且无支链的链烃的结构简式CH≡C-CH=CH-CH=CH2.
,写出B的一种含三键且无支链的链烃的结构简式CH≡C-CH=CH-CH=CH2.
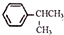 可写成
可写成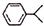
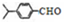 ,上述合成路线中①属于加成反应;
,上述合成路线中①属于加成反应;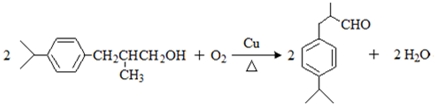 .
.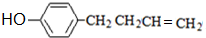 .
.
 ;
; .
.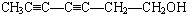 或
或 或
或 .
.