题目内容
【题目】氢气是一种清洁能源,又是合成氨工业的重要原料。
(1)已知:CH4(g)+H2O==CO+3H2(g) △H=206.2 kJ·mol-1。
CH4(g)+CO2(g)==2CO(g)+2H2(g) △H=247.4 kJ·mol-1
甲烷和H2O(g)反应生成H2和CO2的热化学方程式为___________________。
(2)工业合成氨的反应原理为N2(g)+3H2(g)![]() 2NH3(g) △H=-92.4 kJ·mol-1。
2NH3(g) △H=-92.4 kJ·mol-1。
某温度下,把10 mol N2与28 mol H2置于容积为10 L的密闭容器内,10 min时反应达到平衡状态,测 得氮气的平衡转化率为60%,则10 min内该反应的平均速率v(NH3)=__________mol·L-1·min-1,该温度下该反应的平衡常数K=________。 欲增大氮气的平衡转化率,可采取的措施有_____________、____________等(共写两条措施即可,每空一条)。
(3)下图所示装置工作时均与H2有关。
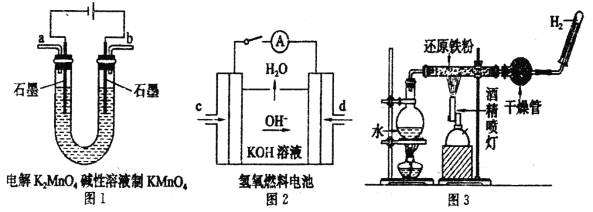
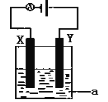
图l所示装置中阳极的电极反应式为______________。
②图2所示装置中,通入H2的管口是_____________(选填字母代号)。
③某同学按图3所示装置进行实验,实验结束后.将玻璃管内固体物质冷却后,溶于稀硫酸,充分反应后,滴加KSCN溶液。溶液不变红,再滴入新制氯水,溶液变为红色。该同学据此得出结论:铁与水蒸气反应生成FeO和H2。该结论_____________(填“严密”或“不严密”),你的理由是(用离子方程式和必要的文字说明)______________________。
【答案】
(1) CH4(g)+2H2O(g)===CO2(g)+4H2(g) ΔH =+165.0 kJ·mol-1
(2) 0.12, 3.6 mol-2·L2 ,
增大压强、增加氢气的浓度、移走氨气、降温(答出其中两项即可)

【解析】
试题分析:(1)CH4(g)+H2O(g)=CO(g)+3H2(g)△H=+206.2kJ/mol①
CH4(g)+CO2(g)=2CO(g)+2H2(g)△H=+247.4kJ/mol②
将方程式①×2-②得CH4(g)+2H2O(g)=CO2(g)+4H2(g)△H=+165.0kJ/mol。
(2)转化的氮气的物质的量=10mol×60%=6mol,则10min内的平均反应速率v(N2)=![]() =0.06mol·L-1·min-1,同一化学反应中同一时间段内各物质的反应速率之比等于其计量数之比, 所以v(NH3)=0.12mol·L-1·min-1;反应达到平衡状态时,c(N2)=
=0.06mol·L-1·min-1,同一化学反应中同一时间段内各物质的反应速率之比等于其计量数之比, 所以v(NH3)=0.12mol·L-1·min-1;反应达到平衡状态时,c(N2)=![]() =0.4mol/L,c(H2)=
=0.4mol/L,c(H2)=![]() =1mol/L,c(NH3)=
=1mol/L,c(NH3)=![]() ==1.2mol/L,z则K=
==1.2mol/L,z则K=![]() =3.6(mol/L)-2。
=3.6(mol/L)-2。
该反应是一个反应前后气体体积减小的放热反应,增加反应物或减小生成物的浓度或降低温度都能使反应向正反应方向移动,所以增加氢气的浓度或分离出氨气或降温都能使该反应向正反应方向移动。
(3)①阳极上锰酸根离子失电子生成高锰酸根离子,电极反应式为:MnO42--e-=MnO4-。②氢氧燃料碱性电池中,氢气失电子和氢氧根离子反应生成水,图片中氢氧根离子向d电极移动,说明d电极上是氢气。③铁和水蒸气在高温下反应生成四氧化三铁和氢气,根据反应现象知,该反应中部分铁未参加反应导致剩余的铁和铁离子反应生成二价铁离子,离子方程式为:2Fe3++Fe=3Fe2+,所以说不严密。

 名校课堂系列答案
名校课堂系列答案【题目】下表是元素周期表的一部分, 针对表中的①~⑩种元素,填写下列空白:[
主族 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0族 |
2 | ① | ② | ③ | |||||
3 | ④ | ⑤ | ⑥ | ⑦ | ⑧ | |||
4 | ⑨ | ⑩ |
(1)在最高价氧化物的水化物中,酸性最强的化合物的分子式是: ,碱性最强的化合物的电子式是: 。
(2)最高价氧化物是两性氧化物的元素是 ;写出它的氧化物与氢氧化钠反应的离子方程式 。
(3)用电子式表示元素④与⑥的化合物的形成过程: 。
(4)表示①与⑦的化合物的电子式 ,该化合物是由 (填“极性”“非极性”)键形成的。
(5)③、⑥、⑦三种元素形成的离子,离子半径由大到小的顺序是_______(要求用离子符号表示)。
(6)元素③的氢化物常温下和元素⑦的单质反应的离子方程式为: 。