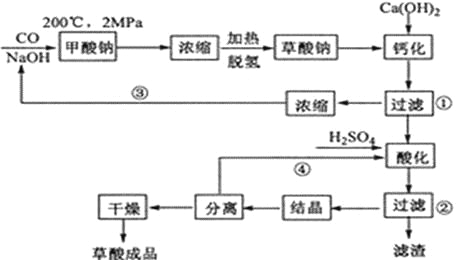
题目内容
【题目】H2C2O4水溶液中H2C2O4、HC2O4-和C2O42-三种形态的粒子的分布分数δ随溶液pH变化的关系如图所示[已知Ksp(CaC2O4)=2.3×10-9].下列说法正确的是( )
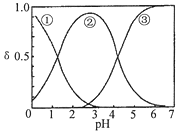
A. 曲线①代表的粒子是HC2O4-
B. 0.1 molL-1NaHC2O4溶液中:c(C2O42-)>c(H2C2O4)
C. pH=5时,溶液中主要含碳物种浓度大小关系为:c(C2O42-)>c(H2C2O4)>c(HC2O4-)
D. 一定温度下,往CaC2O4饱和溶液中加入少量CaCl2固体,c(C2O42-)将减小,c(Ca2+)不变
【答案】B
【解析】试题分析:A、曲线①代表的粒子是H2C2O4,故A错误;B、NaHC2O4溶液pH=4,证明溶液显示酸性,阴离子HC2O4-的电离程度大于其水解程度,所以c(H2C2O4)<c(C2O42-),故B正确;C、pH=5时,溶液中主要含碳物种浓度大小关系为:c(C2O42-)>c(HC2O4-)>c(H2C2O4),故C错误;D、一定温度下,往CaC2O4饱和溶液中,存在CaC2O4(s)![]() C2O42-(aq)+Ca2+(aq)平衡,加入少量CaCl2固体,平衡逆向移动,c(C2O42-)将减小,c(Ca2+)不可抵消,所以c(Ca2+)增大,故D错误;故选B。
C2O42-(aq)+Ca2+(aq)平衡,加入少量CaCl2固体,平衡逆向移动,c(C2O42-)将减小,c(Ca2+)不可抵消,所以c(Ca2+)增大,故D错误;故选B。

【题目】下列实验操作中,可达到对应实验目的的是( )
实验操作 | 实验目的 | |
A | 苯和溴水混合后加入铁粉 | 制溴苯 |
B | 某有机物与溴的四氯化碳溶液混合 | 确认该有机物含碳碳双键 |
C | 将 | 检验该有机物中的溴原子 |
D | 乙醇与酸性高锰酸钾溶液混合 | 检验乙醇具有还原性 |
A. A B. B C. C D. D